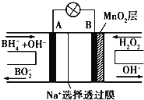
题目内容
【题目】铝用途广泛,用铝土矿(主要成分为Al2O3·nH2O、少量SiO2和Fe2O3)制取Al有如下途径:

(1)滤液A可用于净水,其净水原理用离子方程式表示为_________________。
(2)灼烧时盛放药品的仪器名称是______________
(3)步骤Ⅴ中发生反应的化学方程式是________________________。
(4)步骤Ⅲ中生成固体C的离子反应方程式为__________________________。
(5)取滤液B 100 mL,加入1 mol/L盐酸200 mL,沉淀量达到最大且质量为11.7 g。则滤液B中c(Al O2-)=_____________。(4分)
【答案】
(1)Al3++3H2O![]() Al(OH)3(胶体)+3H+、Fe3++3H2O
Al(OH)3(胶体)+3H+、Fe3++3H2O![]() Fe(OH)3(胶体)+3H+
Fe(OH)3(胶体)+3H+
(2)坩埚
(3)2Al2O3(熔融)![]() 4Al+3O2↑
4Al+3O2↑
(4) AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
(5)1.5 mol/L
【解析】
试题分析:铝土矿溶解在过量稀硫酸中,过滤后得到的滤渣是SiO2,滤液为Al2(SO4)3、H2SO4、Fe2(SO4)3的混合液。因Al3+、Fe3+能水解产生具有吸附作用的Al(OH)3、Fe(OH)3胶体,具有净水作用。向Al2(SO4)3、H2SO4、Fe2(SO4)3的混合液中加入过量NaOH时,Al2(SO4)3转化为NaAlO2,Fe2(SO4)3转化为Fe(OH)3,经过滤后得到滤渣Fe(OH)3。滤液B中含有NaAlO2,向滤液B中通入过量CO2时,生成Al(OH)3和NaHCO3,经过滤后得到固体C[Al(OH)3]和含有NaHCO3、Na2SO4的滤液C。
(1) 滤液A为Al2(SO4)3、H2SO4、Fe2(SO4)3的混合液,Al2(SO4)3、Fe2(SO4)3水解生成胶体,可用于净水,其净水原理用离子方程式表示为Al3++3H2O![]() Al(OH)3(胶体)+3H+、Fe3++3H2O
Al(OH)3(胶体)+3H+、Fe3++3H2O![]() Fe(OH)3(胶体)+3H+,故答案为:Al3++3H2O
Fe(OH)3(胶体)+3H+,故答案为:Al3++3H2O![]() Al(OH)3(胶体)+3H+、Fe3++3H2O
Al(OH)3(胶体)+3H+、Fe3++3H2O![]() Fe(OH)3(胶体)+3H+;
Fe(OH)3(胶体)+3H+;
(2)在坩埚中灼烧Al(OH)3得到Al2O3,故答案为:坩埚;
(3)电解熔融的Al2O3得到Al和O2,故答案为:2Al2O3(熔融)![]() 4Al+3O2↑;
4Al+3O2↑;
(4) 步骤Ⅲ中向滤液B中通入过量CO2时,生成Al(OH)3和NaHCO3,离子反应方程式为AlO2-+CO2+2H2O=Al(OH)3↓+ HCO3-,故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+ HCO3-;
(5)滤液B为含有NaOH、NaAlO2、Na2SO4的混合溶液,加入盐酸生成Al(OH)311.7 g,即n(NaAlO2)=0.15 mol,c(AlO2-)=1.5 mol/L,故答案为:1.5 mol/L。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案