题目内容
在时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K=__________。已知:K300℃>K350℃,则该反应是_______________热反应。
(2)下图中表示NO2的变化的曲线是_____________。用O2表示从0—2 s内该反应的平均速率v=_________。
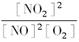
(3)能说明该反应已达到平衡状态的是______________。
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是_________。
a.及时分离出NO2气体
b.适当升高温度
c.增大O2的浓度
d.选择高效催化剂
(1)K=![]() 放热
放热
(2)b 1.5×10-3 mol·L-1·s-1
(3)b c
(4)c
解析:(1)由于K300 ℃>K350 ℃,所以,升高温度化学平衡向逆反应方向移动,该反应为放热反应。
(2)由于NO2的变化量与NO的变化量相等,是O2变化量的2倍,但曲线的变化方向相反,所此可确定b线是NO2的变化曲线。
v(O2)=![]() v(NO)=
v(NO)=![]() =1.5×10-3mol·(L·s)-1
=1.5×10-3mol·(L·s)-1
(3)化学平衡状态是各成分的含量保持不变的状态,原理是正逆反应的速率相等。
a.v(NO2)不能说明是NO2生成的速率还是减少的速率,同理v(O2)也是如此,因此不能判断。
b.容器压强不变说明容器内各气体物质的总分子数不变,由于该反应是反应前后气体分子数不等的反应,就说明了达到平衡状态。
c.由于v逆(NO)=v逆(NO2),所以该式能反映出正逆反应速率相等,能够说明达到平衡状态。
d.这是一个密闭的容器,质量一定不变,而与是否进行反应无关,所以该项不能说明是否达到平衡。
(4)a是减少物质,所以不能增大反应速率,错误。b升高温度平衡向逆反应方向移动,错误。c正确。d催化剂只能改变反应速率,不会影响平衡,错误。

在2 L密闭容器内,800 ℃时反应:2NO(g)+O2(g)2NO2(g),△H<0体系中,n(NO)随时间的变化如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)用O2表示从0~2s内该反应的平均速率v= 。
|
(3)能说明该反应已达到平衡状态的是 。
A.v(NO2)=2v(O2) B.容器内压强保持不变
C.v逆 (NO)=2v正 (O2) D.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是 。
A.及时分离除NO2气体 B.适当升高温度
C.增大O2的浓度 D.选择高效催化剂
在2 L密闭容器内,800 ℃时反应:2NO(g)+O2(g)2NO2(g),△H<0体系中,n(NO)随时间的变化如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)用O2表示从0~2s内该反应的平均速率v= 。
|
(3)能说明该反应已达到平衡状态的是 。
A.v(NO2)=2v(O2) B.容器内压强保持不变
C.v逆 (NO)=2v正 (O2) D.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是 。
A.及时分离除NO2气体 B.适当升高温度
C.增大O2的浓度 D.选择高效催化剂
(9分)在2 L密闭容器内,800℃时反应2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
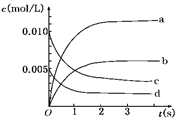
(2)图中表示NO2的变化的曲线是________.用O2表示从0~2 s内该反应的平均速率v=________
(3)能说明该反应已达到平衡状态的是________.
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是________.
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
(I)(10分)某自主学习小组用HNO3与大理石反应过程中质量减小的方法,探究影响反应速率的因素。所用HNO3浓度为1.00 mol·L-1、2.00 mol·L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298 K、308 K,每次实验HNO3的用量为25.0 mL,大理石用量为10.00g。请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
|
实验编号 |
T/K |
大理石规格 |
HNO3浓度/mol·L-1 |
实验目的 |
|
① |
298 |
粗颗粒 |
2.00 |
(Ⅰ)实验①和②探究HNO3浓度对该反应速率的影响; (Ⅱ)实验①和__探究温度对该反应速率的影响; (Ⅲ)实验①和__探究大理石规格(粗、细)对该反应速率的影响。 |
|
② |
|
|
|
|
|
③ |
|
粗颗粒 |
|
|
|
④ |
|
|
|
(II)(5分) 800℃时在2 L密闭容器内加入NO和O2,发生反应:2NO(g)+O2(g) 2NO2(g),正反应放热。测得n(NO)随时间的变化如下表,请回答:
2NO2(g),正反应放热。测得n(NO)随时间的变化如下表,请回答:
|
时间/s |
0 |
1 |
2 |
3 |
4 |
5 |
|
n(NO)/mol |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
(1)NO的平衡浓度c(NO)= ;
(2)用O2表示从0~2s内该反应的平均反应速率为 ;
(3)右图中表示NO2变化的曲线是 ;

(4)在其他条件不变,5min时分别改变下列条件,将改变条件后反应速率的变化情况(“增大”、“减小”或“不变”)填入空格内:①升温 V ②体积不变充入He气体 V
(12分)在2 L密闭容器内,800 ℃时反应2NO(g)+O2(g)  ?2NO2(g)体系中,n(NO)随时间的变化如下表:
?2NO2(g)体系中,n(NO)随时间的变化如下表:
|
时间/s |
0 |
1 |
2 |
3 |
4 |
5 |
|
n(NO)/mol |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
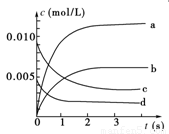
(1)写出该反应的平衡常数表达式:K=________。已知:K300 ℃>K350 ℃,则该反应是________热反应。
(2)如图中表示NO2的变化的曲线是________。用O2表示从0~2 s内该反应的平均速率v=_____ ___。
(3)能说明该反应已达到平衡状态的是________。
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内密度保持不变
(4)能使该反应的反应速率增大,且平衡向逆反应方向移动的是________。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂