题目内容
Na2S2O3溶液跟稀硫酸反应的化学方程式为:Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O.下列各组实验中,溶液中最先变浑浊的是( )
| 反应温度(℃) | 反应物 | H2O | ||||
| Na2S2O3 | H2SO4 | V(mL) | ||||
| V(mL) | c(mol/L) | V(mL) | c(mol/L) | |||
| A | 10 | 5 | 0.1 | 10 | 0.1 | 5 |
| B | 10 | 5 | 0.1 | 5 | 0.1 | 10 |
| C | 30 | 5 | 0.1 | 5 | 0.1 | 10 |
| D | 30 | 5 | 0.2 | 5 | 0.2 | 10 |
| A、A | B、B | C、C | D、D |
分析:由表格中的数据可知,有温度、浓度影响反应速率,浓度越大、温度越大,则反应速率越大,以此来解答.
解答:解:由表格中的数据可知,30℃>10℃,
则C、D 的反应速率大于A、B中的反应速率,
又D中Na2S2O3的浓度大,则D中反应速率大于C中反应速率,
所以D中反应速率最大,
故选D.
则C、D 的反应速率大于A、B中的反应速率,
又D中Na2S2O3的浓度大,则D中反应速率大于C中反应速率,
所以D中反应速率最大,
故选D.
点评:本题考查影响反应速率的因素,注意表格中浓度、温度的比较即可解答,明确温度、浓度ui反应速率的影响即可解答,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
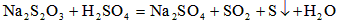 下列各组实验中,溶液中最先变浑浊的是
下列各组实验中,溶液中最先变浑浊的是