题目内容
【题目】全世界每年被腐蚀损耗的钢铁材料约占全年钢铁产量的十分之一。研究钢铁的腐蚀及防护有重要意义。回答下列问题:
(1)钢铁发生腐蚀的主要类型是电化学腐蚀,在电化学腐蚀中,负极反应是_____________,正极反应是_____________。
(2)某实验小组设计下列实验探究铁生锈的条件:
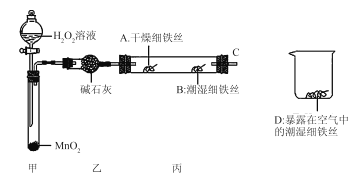
反应4 min后观察,发现A处铁丝依然光亮,B处铁丝表面灰暗,D处铁丝依然光亮。该实验说明铁生锈主要与_________和___________有关;B、D处实验现象对比说明:决定铁生锈的一个重要因素是___________。
(3)金属及塑料制品表面镀铬不仅美观还可提高金属制品抗腐蚀性能。常见镀铬液由重铬酸(H2Cr2O7)和催化剂硫酸组成。
①重铬酸中,Cr元素的化合价为________。
②镀铬时由CrO42-放电产生铬镀层。阴极的电极反应式为_______。
(4)电镀废水中Cr2O72-具有高毒性,必须经处理后才能排放。电解法处理含铬的强酸性废水的原理如右图所示。
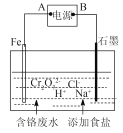
电解产生的Fe2+将Cr2O72-还原为Cr3+,再随着溶液pH的升高,便有Fe(OH)3和Cr(OH)3沉淀生成。
①图中A为电源__________极;电解时阴极产生的气体为____________(写化学式)。
②写出Fe2+与Cr2O72-反应的离子方程式:_________________。
【答案】(1)Fe-2e-=Fe2+(或 2Fe-4e-=2Fe2+);2H2O+O2+4e-=4OH-
(2)水(1分);氧气(1分);氧气的浓度(2分)
(3)①+6(1分)②CrO42- + 8H++ 6e-=Cr +4H2O(2分)
(4)①正;H2②6Fe2+ +Cr2O72- +14H+=6Fe3++2Cr3++7H2O
【解析】
试题分析:(1)钢铁发生腐蚀的主要类型是电化学腐蚀,主要为吸氧腐蚀,金属铁做负极,失去电子,发生氧化反应:Fe-2e-=Fe2+ 正极是溶解在溶液中的氧气得电子发生还原反应:O2+2H2O+4e-=4OH- ;根据实验现象,得出铁生锈主要与氧气和水有关;当水为定值时,主要看氧气的浓度;
(3)①根据化合价法则,H2Cr2O7中,Cr元素的化合价为+6,镀铬时由CrO42-放电产生铬镀层。阴极发生还原反应,+6价Cr还原为0价Cr;根据电子得失守恒:CrO42- + 8H++ 6e-=Cr +4H2O;
(4)电解产生的Fe2+将Cr2O72-还原为Cr3+,再随着溶液pH的升高,便有Fe(OH)3和Cr(OH)3沉淀生成。说明金属铁做阳极,发生氧化反应,变为Fe2+,图中A为电源正极,阴极产生的气体为H2;Fe2+被Cr2O72-氧化为Fe3+ ;Cr2O72-还原为Cr3+,根据电荷守恒,写出6Fe2+ +Cr2O72-+14H+=6Fe3++2Cr3++7H2O;