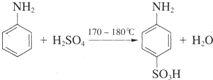
题目内容
(2010?江苏二模)下列溶液中有关粒子的物质的量浓度关系正确的是( )
分析:A、氯气和水反应是化学平衡,氯气不能完全溶于水,1体积水大约溶解2体积的氯气,氯元素存在形式有氯离子、次氯酸、氯气、次氯酸根;
B、溶液PH相同氢氧根离子难度相同,依据电离生成离子的量分析计算;
C、pH=4的0.1 mol?L-1的NaHA溶液呈酸性,电离大于水解;
D、依据溶液中质子守恒计算分析;
B、溶液PH相同氢氧根离子难度相同,依据电离生成离子的量分析计算;
C、pH=4的0.1 mol?L-1的NaHA溶液呈酸性,电离大于水解;
D、依据溶液中质子守恒计算分析;
解答:解:解:A.因氯气不能完全溶解,则氯水中2c(Cl2)>c(ClO-)+c(Cl-)+c(HClO),故A错误;
B.pH=12,电离产生的c(OH-)都为0.01mol/L,所以pH=12的NaOH溶液与pH=12的氨水中存在c(Na+)=c(NH4+),故B正确;
C.pH=4的0.1mol?L-1的NaHA溶液,HA-的电离大于其水解,电离生成A2-,水解生成H2A,所以c(HA-)>c(H+)>c(A2-)>c(H2A),故C错误;
D、对于Na2CO3,质子守恒:H++HCO3-+2H2CO3=OH-;对于NaHCO3,质子守恒:H++H2CO3=OH-+CO32-;两边相加,有2H++HCO3-+3H2CO3=2OH-+CO32-;故D错误;
故选B.
B.pH=12,电离产生的c(OH-)都为0.01mol/L,所以pH=12的NaOH溶液与pH=12的氨水中存在c(Na+)=c(NH4+),故B正确;
C.pH=4的0.1mol?L-1的NaHA溶液,HA-的电离大于其水解,电离生成A2-,水解生成H2A,所以c(HA-)>c(H+)>c(A2-)>c(H2A),故C错误;
D、对于Na2CO3,质子守恒:H++HCO3-+2H2CO3=OH-;对于NaHCO3,质子守恒:H++H2CO3=OH-+CO32-;两边相加,有2H++HCO3-+3H2CO3=2OH-+CO32-;故D错误;
故选B.
点评:本题考查离子浓度大小的比较,明确溶液中的电离与水解及电离与水解的趋势是解答本题的关键,并注意利用电荷守恒来解答,选项A为易错点,题目难度中等.

练习册系列答案
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案
相关题目