题目内容
从海水中可以提取溴,主要反应为:2Br-+Cl2====Br2+2Cl-,下列说法正确的是
( )
A.溴离子具有氧化性 B.氯气是还原剂
C.该反应属于复分解反应 D.氯气的氧化性比溴单质强
选D。溴离子中的Br为-1价,处于最低价态,没有氧化性;在反应中Cl2中的Cl价态由0价降低到-1价,做氧化剂;从基本反应类型来看,该反应属于置换反应;氯气为氧化剂, Br2为氧化产物,因此,氯气的氧化性比溴单质强。
Br2为氧化产物,因此,氯气的氧化性比溴单质强。

练习册系列答案
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案
相关题目
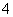 、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、NO3-、SO42-、CO32-,已知:
、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、NO3-、SO42-、CO32-,已知: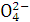 的盐溶液能与Ba(NO3)2溶液反应,产生白色沉淀
的盐溶液能与Ba(NO3)2溶液反应,产生白色沉淀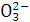 的盐
的盐