题目内容
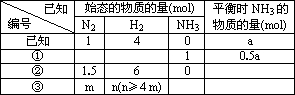
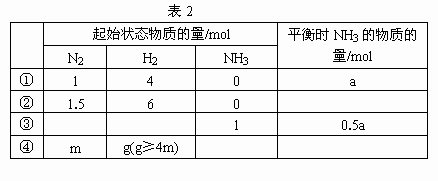
在一个盛有催化剂容积可变的密闭容器中,保持一定温度和压强,进行以下反应:N2+3H2 2NH3.已知加入1mol N2和4mol H2时,达到平衡后生成a mol NH3(见下表已知项).在相同温度、压强下,保持平衡时各组分的体积分数不变,对下列编号为①~④的状态,填写表2中的空白.
2NH3.已知加入1mol N2和4mol H2时,达到平衡后生成a mol NH3(见下表已知项).在相同温度、压强下,保持平衡时各组分的体积分数不变,对下列编号为①~④的状态,填写表2中的空白.
解析:
|
②1.5a;③0,0.5;④2(g-4m)(g-3m)a 导解:是等效平衡.在等温等压的条件下,对于任一反应,改变起始加入情况,只要按化学计量数换算成方程式同一边物质的物质的量之比与原平衡相同,两平衡等效,各物质在平衡混合物中的物质的量分数、体积分数、质量分数相同,但平衡浓度不同,每一次平衡浓度都成比例,与加入量的比例相同.此题只要抓住有关的比例即可.题目给的原始状态①为n(N2)∶n(H2)∶n(NH3平衡)=1∶4∶a,状态②的加入量为①的1.5倍,所以n(NH3平衡)=1.5a;③n(NH3平衡)=0.5a,若起始时n(NH3)=0,n(N2)和n(H2)应为①的0.5倍,n(N2)=0.5mol,n(H2)=2mol,但现在起始时n(NH3)=1mol,相当于提供了N2 0.5mol,H2 1.5mol,所以起始时已加入的n(N2)=0,n(H2)=0.5mol;④设起始时氨为x mol,设平衡时氨为y mol,(m+x/2)∶(g+3x/2)=1∶4,求出x=2(g-4m),4∶a=(g+3x/2)∶y,求出y=(g-3m)a. |

(7分)在一个盛有催化剂容积可变的密闭容器中,保持一定的温度和压强,进行以下反应:N2+3H2⇌2NH3已知加入1 mol N2、4 mol H2时,达到平衡后生成a mol NH3(见表中已知项),在相同温度和压强下保持平衡后各组分体积分数不变,对下列编号①~③的状态,填写表中空白。
| 已知编号 | 始态的物质的量(mol) | 平衡时NH3的 物质的量(mol) | ||
| N2 | H2 | NH3 | ||
| 已知 | 1 | 4 | 0 | a |
| ① |
|
| 1 | 0.5a |
| ② | 1.5 | 6 | 0 |
|
| ③ | m | n( n≥4m) |
|
|
(7分)在一个盛有催化剂容积可变的密闭容器中,保持一定的温度和压强,进行以下反应:N2+3H2⇌2NH3已知加入1 mol N2、4 mol H2时,达到平衡后生成a mol NH3(见表中已知项),在相同温度和压强下保持平衡后各组分体积分数不变,对下列编号①~③的状态,填写表中空白。
|
已知编号 |
始态的物质的量(mol) |
平衡时NH3的 物质的量(mol) |
||
|
N2 |
H2 |
NH3 |
||
|
已知 |
1 |
4 |
0 |
a |
|
① |
|
|
1 |
0.5a |
|
② |
1.5 |
6 |
0 |
|
|
③ |
m |
n( n≥4m) |
|
|