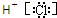题目内容
用价电子对互斥理论(VSEPR)可以预测许多分子或离子的空间构型,也可推测键角大小,下列判断正确的是
| A.CS2是V形分子 | B.SnBr2键角大于120° |
| C.BF3是三角锥形分子 | D.NH4+键角等于109.5° |
D
试题分析:A、CS2分子的结构与二氧化碳相同,均是直线形结构,A不正确;B、SnBr2中Sn的价层电子对数=2,且不含有孤对电子,所以早自习结构,键角是120°,B不正确;C、BF3是平面三角形结构,C不正确;D、NH4+是正四面体形结构,键角等于109.5°,D正确,答案选D。

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案
相关题目