题目内容
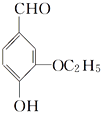
【题目】由E(![]() )转化为对甲基苯乙炔(
)转化为对甲基苯乙炔(![]() ) 的一条合成路线如下:
) 的一条合成路线如下:![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
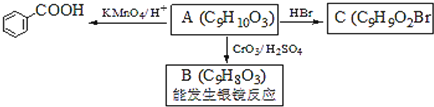
![]() (G为相对分子质量为118的烃)。下列说法不正确的是( )
(G为相对分子质量为118的烃)。下列说法不正确的是( )
A. G的结构简式:![]()
B. 第④步的反应条件是NaOH的水溶液,加热
C. 第①步的反应类型是还原反应
D. E能发生银镜反应
【答案】B
【解析】
由E合成对甲基苯乙炔的过程实际上就是由-CH2CHO转化成-CH=CH2,最终转化成-C≡CH的过程,具体过程为可以先发生-CHO与氢气的加成反应生成F,再发生醇在浓硫酸、加热的条件下的消去反应,然后与溴发生加成反应引入两个溴原子,最后发生卤代烃在NaOH醇溶液中加热,发生消去反应生成C≡C,流程为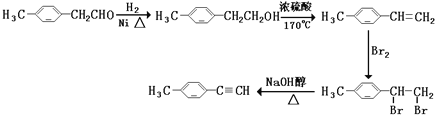 。则
。则
A. 根据以上分析可知G的结构简式为![]() ,A正确;
,A正确;
B. 第④步的反应是卤代烃的消去反应,反应条件是NaOH的醇溶液,加热,B错误;
C. 第①步是醛基的加成反应,反应类型也是还原反应,C正确;
D. E分子中含有醛基,能发生银镜反应,D正确。
答案选B。

 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案【题目】某学生对Na2SO3与AgNO3在不同pH下的反应进行探究。
(1)测得0.1mol/L的Na2SO3溶液pH=11,其原因是___________(用离子方程式解释)
(2)调节pH,对两者的反应进行了如下实验并记录了实验现象(实验都在锥形瓶中完成,且所用锥形瓶均进行振荡)
实验 | pH | 实验现象 |
1 | 10 | 产生白色沉淀,稍后溶解,溶液澄清 |
2 | 6 | 产生白色沉淀,放置长时间后无变化 |
3 | 2 | 产生白色沉淀,一段时间后,变为棕黑色海绵状沉淀X |
已知:
A.Ag2SO3:白色不溶于水,能溶于过量Na2SO3溶液
B.Ag2SO4:白色微溶于水,只能溶于浓硝酸
C.Ag2O:棕黑色,能与酸反应
①根据以上信息,解释实验1中白色沉淀溶解可能的原因___________
②甲同学对于实验2中的白色沉淀的成分,提出如下猜想
猜想1:白色沉淀为Ag2SO3
猜想2:白色沉淀为Ag2SO4
猜想3:白色沉淀中既有Ag2SO3也有Ag2SO4
为了证明其猜想,甲同学过滤实验2中的白色沉淀,加入_________溶液,发现白色沉淀部分溶解;再将剩余固体过滤出来,加入_________溶液,沉淀完全溶解,由此证明猜想3成立。
(3)乙同学为了确定实验3中棕黑色沉淀X的成分,做了如下实验
①向X中加入稀盐酸,无明显变化
②向X中加入过量浓硝酸,有红棕色气体生成
③分别用Ba(NO3)2溶液和BaCl2溶液检验实验②反应后的溶液,发现前者无变化,后者产生白色沉淀,其中,实验①的目的为___________,由上述实验现象可确定沉淀X的成分为___________(填化学式),实验②的化学方程式为___________。