题目内容
工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下所示:
请回答下列问题:
(1)反应②是________(填“吸热”或“放热”)反应。
(2)据反应①与②可推导出K1、K2与K3之间的关系,则K3=__________(用K1、K2表示)。
(3)500 ℃时测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol·L-1)分别为0.8、0.1、0.3、0.15,则此时v正________v逆(填“>”、“=”或“<”)。
(4)反应①按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如下图所示。下列说法正确的是__________(填序号)。
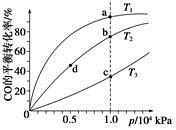
A.温度:T1>T2>T3
B.正反应速率:v(a)>v(c),v(b)>v(d)
C.平衡常数:K(a)>K(c),K(b)=K(d)
D.平均摩尔质量:M(a)>M(c),M(b)>M(d)
| 化学反应 | 平衡 常数 | 温度/℃ | ||
| 500 | 700 | 800 | ||
①2H2(g)+CO(g) CH3OH(g) CH3OH(g) | K1 | 2.5 | 0.34 | 0.15 |
②H2(g)+CO2(g) H2O(g)+CO(g) H2O(g)+CO(g) | K2 | 1.0 | 1.70 | 2.52 |
③3H2(g)+CO2(g) CH3OH(g)+H2O(g) CH3OH(g)+H2O(g) | K3 | | | |
请回答下列问题:
(1)反应②是________(填“吸热”或“放热”)反应。
(2)据反应①与②可推导出K1、K2与K3之间的关系,则K3=__________(用K1、K2表示)。
(3)500 ℃时测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol·L-1)分别为0.8、0.1、0.3、0.15,则此时v正________v逆(填“>”、“=”或“<”)。
(4)反应①按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如下图所示。下列说法正确的是__________(填序号)。

A.温度:T1>T2>T3
B.正反应速率:v(a)>v(c),v(b)>v(d)
C.平衡常数:K(a)>K(c),K(b)=K(d)
D.平均摩尔质量:M(a)>M(c),M(b)>M(d)
(1)吸热 (2)K1·K2 (3)> (4)CD
(1)由表中数据知,温度越高,平衡常数越大,所以反应②为吸热反应。
(2)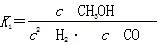
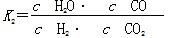
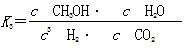
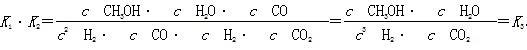
(4)根据反应①中温度与K的关系,可推断该反应为放热反应,升温,平衡左移,CO的转化率减小,所以T3>T2>T1,A错误;反应速率v(c)>v(a),v(b)>v(d),B错误;温度越高,平衡常数越小,压强对平衡常数无影响,所以K(a)>K(c),K(b)=K(d);升温,平衡左移,平均摩尔质量减小,加压,平衡右移,平均摩尔质量增大,所以M(a)>M(c),M(b)>M(d)。
(2)
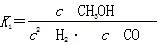
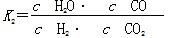
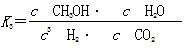
(4)根据反应①中温度与K的关系,可推断该反应为放热反应,升温,平衡左移,CO的转化率减小,所以T3>T2>T1,A错误;反应速率v(c)>v(a),v(b)>v(d),B错误;温度越高,平衡常数越小,压强对平衡常数无影响,所以K(a)>K(c),K(b)=K(d);升温,平衡左移,平均摩尔质量减小,加压,平衡右移,平均摩尔质量增大,所以M(a)>M(c),M(b)>M(d)。

练习册系列答案
相关题目
 xC(g)+2D(g),经4min后测得D的浓度为0.5mol/L,c(A):c(B)=3:5,以C表示的平均速率v(C)=0.125mol·L-1·min-1,下列说法正确的是
xC(g)+2D(g),经4min后测得D的浓度为0.5mol/L,c(A):c(B)=3:5,以C表示的平均速率v(C)=0.125mol·L-1·min-1,下列说法正确的是 CH3OH(l)+H2O(l) ΔH=-130.9 kJ·mol-1
CH3OH(l)+H2O(l) ΔH=-130.9 kJ·mol-1
 W(?)+4Q(g) ΔH<0,起始投料只有M和N。下列示意图正确且能表示该可逆反应达到平衡状态的是
W(?)+4Q(g) ΔH<0,起始投料只有M和N。下列示意图正确且能表示该可逆反应达到平衡状态的是
 pC(g)+qD(其中A和C都是无色气体),当达到平衡时,下列叙述正确的是( )
pC(g)+qD(其中A和C都是无色气体),当达到平衡时,下列叙述正确的是( ) 2C(g)(正反应放热)。这个可逆反应的正确图像为( )
2C(g)(正反应放热)。这个可逆反应的正确图像为( )
 C达到平衡后,B的转化率与压强、温度的关系如下图,下列说法正确的是( )
C达到平衡后,B的转化率与压强、温度的关系如下图,下列说法正确的是( )
 N2O4的可逆反应中,下列状态一定属于平衡状态的是( )
N2O4的可逆反应中,下列状态一定属于平衡状态的是( )