题目内容
在反应MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O中,
(1)被氧化的元素是
(2)被氧化的HCl与参加反应的HCl的物质的量之比为
(3)请在题中用双线桥法标明电子转移的方向和数目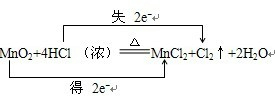
 .
.
| ||
(1)被氧化的元素是
Cl
Cl
,氧化剂是MnO2
MnO2
,氧化产物是Cl2
Cl2
.(2)被氧化的HCl与参加反应的HCl的物质的量之比为
1:2
1:2
(3)请在题中用双线桥法标明电子转移的方向和数目


分析:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O中,Mn元素的化合价降低,Cl的元素的化合价升高,以此来解答.
| ||
解答:解:(1)Cl元素的化合价升高,在反应中被氧化,氧化产物为Cl2,Mn元素的化合价降低,则MnO2为氧化剂,
故答案为:Cl;MnO2;Cl2;
(2)由反应可知,4molHCl反应其中2mol作还原剂被氧化,则被氧化的HCl与参加反应的HCl的物质的量之比为1:2,故答案为:1:2;
(3)在MnO2+4HCl (浓)
MnCl2+Cl2↑+2H2O的反应中,锰元素化合价降低,氯元素化合价升高,转移电子数为2mol,用“双线桥法”表示氧化还原反应中电子转移情况为: ,故答案为:
,故答案为: .
.
故答案为:Cl;MnO2;Cl2;
(2)由反应可知,4molHCl反应其中2mol作还原剂被氧化,则被氧化的HCl与参加反应的HCl的物质的量之比为1:2,故答案为:1:2;
(3)在MnO2+4HCl (浓)
| ||
 ,故答案为:
,故答案为: .
.点评:本题考查氧化还原反应,侧重基本概念及转移电子数的考查,明确反应中元素的化合价变化即可解答,题目难度不大.

练习册系列答案
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案
相关题目
A~G各物质间的关系如图所示,其中B、D为气体单质.则下列说法错误的是( )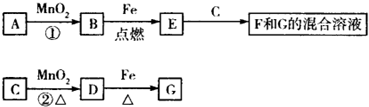

| A、若反应①在常温下进行,则1 mol A在反应中能转移1 mol电子 | ||||
B、反应②的离子方程式为MnO2+4H++2Cl-
| ||||
| C、新配制的F溶液一般需要加入铁屑和稀盐酸,前者用于防止Fe2+被空气氧化成Fe3+,后者可抑制Fe2+的水解 | ||||
| D、已知C的浓溶液在催化剂存在的条件下加热,能与B反应生成D,由此可以推断B的氧化性比MnO2强 |

 (2012?大连模拟)已知A、B、C为中学化学中常见的单质.室温下,A为固体,B和C均为气体.在适宜的条件下,它们可以按所示框图进行反应.
(2012?大连模拟)已知A、B、C为中学化学中常见的单质.室温下,A为固体,B和C均为气体.在适宜的条件下,它们可以按所示框图进行反应.