题目内容
相同物质的量浓度的下列溶液(在相同温度下),pH由小到大的排列顺序中,正确的是( )
①CH3COONa;②NaHCO3;③C6H5ONa;④NaCl;⑤NaHSO4.
①CH3COONa;②NaHCO3;③C6H5ONa;④NaCl;⑤NaHSO4.
分析:根据碱溶液的pH>盐溶液的pH>酸溶液的pH,及盐溶液中强酸弱碱盐水解显酸性、强碱弱酸盐水解显碱性、不水解的盐显中性、盐中有弱才水解、越弱越水解等来解答.
解答:解:①CH3COONa;②NaHCO3;③C6H5ONa都为强碱弱酸盐,水解呈碱性,因酸性:CH3COOH>H2CO3>C6H5OH,酸越弱,则对应的盐水解程度越大,则pH③>②>①,
NaCl为强酸强碱盐,溶液呈中性,NaHSO4可电离出氢离子,溶液呈酸性,
则pH由小到大的排列顺序中,正确的是⑤④①②③,
故选C.
NaCl为强酸强碱盐,溶液呈中性,NaHSO4可电离出氢离子,溶液呈酸性,
则pH由小到大的排列顺序中,正确的是⑤④①②③,
故选C.
点评:本题考查盐类水解的原理及应用,侧重于学生的分析能力可基本理论知识的综合运用的考查,注意把握盐类水解的原理以及影响因素,难度不大.

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案
相关题目
已知同温度、同物质的量浓度的NaX溶液的pH值大于NaY溶液的pH值,据此,下列对两种对应酸(HX和HY)在相同温度和浓度下的比较中正确的是( )
| A、c(X-)>c(Y-) | B、电离程度:HX>HY | C、HY溶液的pH值>HX溶液的pH | D、HY溶液中的c(H+)>HX溶液中的c(H+) |
中学化学教材中有大量数据,下列为某同学对数据的利用情况,其中不正确的是( )
| A、用沸点数据推测两种液体混合物用蒸馏方法分离开来的可能性 | B、用几种一元弱酸的电离常数Ka来比较相同温度下相同物质的量浓度的这几种一元弱酸的钠盐溶液的碱性强弱 | C、用几种相同类型的难溶电解质的Ksp来比较相同温度下它们的溶解度的大小 | D、用熔、沸点数据来分析分子的稳定性 |
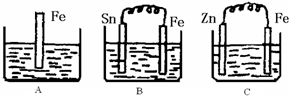
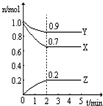
 2Z
2Z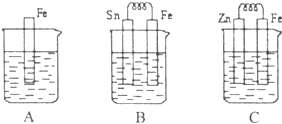 I.A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸.
I.A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸.