题目内容
下图是部分短周期元素原子半径与原子序数的关系图。则下列说法正确的是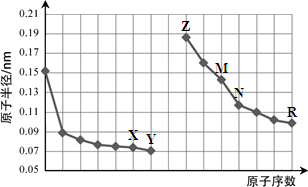
| A.Y、R两种元素的气态氢化物及其最高价氧化物的水化物均为强酸 |
| B.简单离子的半径:X > Z > M |
| C.由X与N两种元素组成的化合物不能与任何酸反应,但能与强碱反应 |
| D.Z单质不能从M与R元素构成的盐溶液中置换出单质M |
BD
解析试题分析:由关系图可知X是O;Y是F;Z是Na; M是Al;N是Si;R是Cl.A. F的气态氢化物HF的水化物是弱酸,无最高价氧化物的水化物;而Cl的气态氢化物HCl的水化物是强酸,其最高价氧化物的水化物HClO4是强酸。错误。B.O2-、Na+、Al3+是电子层结构相同的离子,核电荷数越大,离子的半径就越小。正确。C.由O与Si两种元素组成的化合物SiO2能与氢氟酸反应SiO2+4HF=SiF4↑+ 2H2O,也能与强碱发生反应SiO2+2NaOH=Na2SiO3+H2O。错误。Na的活动性很强,当将其放入AlCl3溶液使,首先与水发生反应:2Na+2H2O=2NaOH+H2↑;发生反应的产物继续发生反应AlCl3+3NaOH=Al(OH)3↓+3NaCl。因此不能把Al从溶液中置换出来。
考点:考查元素的推断及元素与化合物的性质的知识。

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
铊是超导材料的组成元素之一,铊在周期表中位于第六周期,与铝是同族元素,元素符号是Tl,以下对铊的性质的推断不正确的是
| A.铊是易导电的银白色金属 | B.能生成+3价离子化合物 |
| C.T1(OH)3是两性氢氧化物 | D.Tl的失电子能力比Al强 |
已知短周期元素的离子aA2+、bB+、cC3-、dD- 都具有相同的电子层结构,则下列叙述正确的是
| A.原子半径A>B>D>C | B.原子序数 d > c > b > a |
| C.离子半径C>D>B>A | D.单质的还原性A>B>D>C |
已知下列元素的原子半径如下表所示: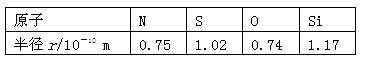
根据以上数据,磷原子的半径可能是
| A.1.10 ×10-10 m | B.0.80×10-10 m | C.1.20× 0-10 m | D.0.70×10-10 m |
X元素最高氧化物对应的水化物为H3XO4,则它对应的气态氢化物为
| A.HX | B.H2X | C.XH4 | D.XH3 |
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Y原子的最外层电子数是其电子层数的3倍。下列说法正确的是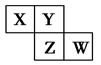
| A.元素Y和元素Z的最高正化合价相同 |
| B.单核阴离子半径的大小顺序为:r(W)>r(Y)>r(Z) |
| C.气态氢化物稳定性:X <Y<Z<W |
| D.元素W的最高价氧化物对应的水化物是强酸 |
短周期元素R、T、Q、W在元素周期表中的相对位置如右下图所示,其中T所处的周期序数与族序数相等。下列判断不正确的是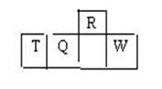
| A.最简单气态氢化物的热稳定性:R>Q |
| B.最高价氧化物对应水化物的酸性:Q<W |
| C.原子半径:T>Q>R |
| D.含T的盐溶液一定显酸性 |