题目内容
(8分)以海水中常见的物质A为原料可以发展很多种工业,下图中包含了几种基本工业生产,请根据各物质之间的转化关系
回答下列问题:
(1)C和D、C和G反应都可以制取消毒剂。C和G反应制取的消毒剂中有效成分的化学式为__________________________。
(2)若使工业合成J反应的化学平衡向生成J的方向移动,可采取的措施有_______________(填字母编号)。
A.升高温度 B.增大压强 C.使用催化剂 D.液化分离J
(3)将F和J通入A的饱和溶液中的顺序为_______________。
A.先通入F后通入J B.选通入J后通入F
C.同时通入 D.没有先后顺序要求
(4)图中所示工业制法获得的纯碱中常含有NaCl杂质,用下述方法可以测定样品中NaCl的质量分数。
①检验沉淀是否洗涤干净所用到的试剂是______________________,
②样品中NaCl的质量分数的数学表达式为__________________________。
(1)Ca(ClO)2(1分)
(2)B D(2分)
(3)B(2分)
(4)①AgNO3溶液(1分,其他合理答案均可)
② (2分)
(2分)
解析考点:无机物的推断;电解原理;探究物质的组成或测量物质的含量.
分析:依据转化关系中的特征反应分析推断,A为NaCl,H为N2,B为H2,J为NH3,E为CaO,G为Ca(OH)2,F为CO2,F+J+A=K+L是候氏制碱的反应原理,生成产物K为NH4Cl,L为NaHCO3,依据判断出的各物质的性质结构分析回答问题.
解答:解:空气分离主要是氧气和氮气;饱和食盐水电解产物为氢气、氯气、氢氧化钠;贝壳分解生成氧化钙和二氧化碳;分析推断,A为NaCl,H为N2,B为H2,J为NH3,E为CaO,G为Ca(OH)2,F为CO2,F+J+A=K+L是候氏制碱的反应原理,生成产物K为NH4Cl,L为NaHCO3;
(1)C(Cl2)和D(NaOH)、C和G反应都可以制取消毒剂.C(Cl2)和G(Ca(OH)2)反应制取的消毒剂中有效成分次氯酸钙,化学式为:Ca(ClO)2;故答案为:Ca(ClO)2;
(2)电解A溶液为饱和食盐水溶液,反应的化学方程式:2NaOH+2H2O Cl2↑+H2↑+2NaOH;故答案为:2NaOH+2H2O
Cl2↑+H2↑+2NaOH;故答案为:2NaOH+2H2O Cl2↑+H2↑+2NaOH;
Cl2↑+H2↑+2NaOH;
(3)若使工业合成J(NH3)反应的平衡向生成NH3的方向移动,依据化学平衡的影响因素进行判断;化学平衡为:N2+3H2 2NH3,正反应方向是放热反应,气体体积减小的反应;
2NH3,正反应方向是放热反应,气体体积减小的反应;
A、升高温度平衡逆向进行,故A不符合;
B、增大压强平衡向气体体积减小的反应方向进行,即正向进行,故B符合;
C、使用催化剂只改变速率,不改变化学平衡,故C不符合;
D、液化分离,首先液化的是氨气,分离出氨气平衡正向进行,故D符合;
故答案为:B D;
(4)将F(CO2)和J(NH3)通入A(NaCl)的饱合溶液中,应先通入氨气,因为氨气极易溶于水,再通入二氧化碳,会很好的吸收二氧化碳,使用通入的顺序为B;
故答为:B;
(5)①沉淀是BaCO3,检验沉淀是否洗涤干净的目的是避免氯化钠在沉淀表面影响测定结果,所用到的试剂是AgNO3溶液;
②样品中NaCl的质量分数的数学表达式:ng沉淀为碳酸钡,是碳酸钠完全沉淀生成的,物质的量相同,106所以样品中氯化钠的质量分数= ×100%=
×100%=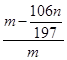 ×100%;故答案为:
×100%;故答案为: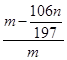 ×100%;
×100%;
点评:本题考查了物质转化关系的应用,物质性质的综合应用,特征反应的判断利用,电解原理的分析利用,化学平衡的影响因素运用判断,物质的除杂方法和杂质的含量测定方法和有关计算.




