题目内容
下图表示一些晶体中的某些结构,它们分别是NaCl、CsCl、干冰、金刚石、石墨结构中的某一种的某一部分。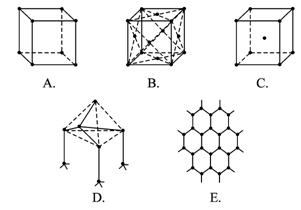
(1)代表金刚石的是(填字母编号,下同)_______________,其中每个碳原子与_______________个碳原子最接近且距离相等。金刚石属于_______________晶体。
(2)代表石墨的是_____________,其中每个正六边形占有的碳原子数平均为__________个。
(3)代表NaCl的是_______________,每个Na+周围与它最接近且距离相等的Na+有_____个。
(4)代表CsCl的是_______________,它属于晶体_______________,每个Cs+与_________个Cl-紧邻。
(5)代表干冰的是_______________,它属于_______________晶体,每个CO2分子与_________个CO2分子紧邻。
(6)若说“离子晶体中只有离子键,分子晶体中没有化学键”是否正确?简答理由。
(7)NaCl晶体、HCl晶体、干冰、金刚石熔点由高而低的顺序是_______________;其中在熔融或液态时能导电的电解质是_______________,液态不导电但为电解质的是_____________,在水溶液中能导电的非电解质是_______________。
解析:根据不同物质晶体的结构特点来辨别图形所代表的物质。NaCl晶体是简单立方单元,每个Na+与6个Cl-紧邻,每个Cl-又与6个Na+紧邻,但观察Na+周围与它最接近且距离相等的Na+数时要抛开Cl-,从空间结构上看是12个Na+。即x轴面上、y轴面上、z轴面上各4个。CsCl晶体由Cs+、Cl-分别构成立方结构,但Cs+组成立方的中心有1个Cl-,Cl-组成的立方中心又镶入一个Cs+。可称为“体心立方”结构,Cl-紧邻8个Cs+,Cs+紧邻8个Cl-。干冰也是立方体结构,但在立方体每个正方形面的中央都有一个CO2分子,称为“面心立方”。实际上各面中央的CO2分子也组成立方结构,彼此相互套入面的中心。所以每个CO2分子在三维空间里x、y、z三个面各紧邻4个CO2分子,共12个CO2分子。金刚石的基本单元是正四面体,每个碳原子紧邻4个其他碳原子。石墨的片层由正六边形结构组成,每个碳原子紧邻另外3个碳原子,即每个六边形占有1个碳原子的各![]() ,所以在的结构中每个六边形占有的碳原子数是6×
,所以在的结构中每个六边形占有的碳原子数是6×![]() =2(个)。
=2(个)。
对于晶体中的化学键要分清是指晶格质点之间还是晶格质点内部。常见的离子晶体其离子间形成的是离子键。原子晶体则只有晶格质点即原子间的共价键。分子晶体在分子间只是弱作用力,即范德华力,而分子内部除单原子分子的惰性气体外都有牢固的共价键。
晶体熔点通常由晶格质点间作用力而定。原子晶体中原子间的共价键牢固,熔点达千至数千摄氏度。离子晶体中离子间的离子键相当强大,熔点在数百至上千摄氏度。分子晶体中分子间作用力弱,熔点在数百摄氏度以下至很低的温度。如果形成分子晶体的分子比较类似,则分子的摩尔质量越大,分子间作用力也越大,熔点也就越高。
题述的NaCl、HCl、CO2、金刚石在熔态时只有离子晶体熔化后能导电。在溶液中离子晶体和分子晶体中的电解质(如HCl)能导电。CO2是非电解质,其水溶液能微弱导电,这是由于CO2与水生成的H2CO3是弱电解质的缘故,所以CO2不是电解质,H2CO3才是电解质。金刚石是原子晶体,所以不溶于一般无机或有机溶剂,它没有水溶液。
答案:(1)D 4 原子
(2)E 2
(3)A 12
(4)C 离子 8
(5)B 分子 12
(6)不正确。原子团离子中有共价键;除稀有气体外,分子内均有共价键。
(7)C>NaCl>CO2>HCl NaCl HCl 干冰

 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案




