题目内容
设nA为阿伏加德罗常数的数值,下列说法正确的是
| A.常温常压下,8gO2含有4nA个电子 |
| B.1L0.1mol?L-1的氨水中有nA个NH4+ |
| C.标准状况下,22.4L盐酸含有nA个HCl分子 |
| D.1molNa被完全氧化生成Na2O2,失去2nA个电子 |
A
氧气的相对分子质量为32,其摩尔质量为32 g/mol,由m/M=n可得,n(O2)=8g÷32g/mol=1/4mol,由于1个O原子含有8个电子,1个O2含有16个电子,则电子与氧气的物质的量之比等于16,由此可得关系式O2~16 e-,其中电子与氧气的物质的量之比等于系数之比,则n(电子)=16 n(O2)=16×1/4mol=4mol,N(电子)= n(电子)?NA="4mol" ×nAmol-1=4nA,A项正确;假设氨水的溶质为NH3?H2O,由c?V=n可得,n(NH3?H2O)=c?V=0.1mol/L×1L=0.1mol,由于NH3?H2O是弱碱,不能完全电离出铵根离子,其电离是可逆反应,即NH3?H2O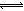 NH4++OH-,则n(NH4+)远远小于n(NH3?H2O),则N(NH4+)远远小于0.1nA,B项错误;盐酸是液体,不能用V÷22.4L/mol计算出其物质的量,且HCl是强酸,在水中能完全电离成氢离子和氯离子,不可能存在HCl分子,C项错误;由钠的性质可得:2Na+O2
NH4++OH-,则n(NH4+)远远小于n(NH3?H2O),则N(NH4+)远远小于0.1nA,B项错误;盐酸是液体,不能用V÷22.4L/mol计算出其物质的量,且HCl是强酸,在水中能完全电离成氢离子和氯离子,不可能存在HCl分子,C项错误;由钠的性质可得:2Na+O2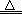 Na2O2,根据化合价升高总数等于失去电子数可得如下关系式:2Na+O2
Na2O2,根据化合价升高总数等于失去电子数可得如下关系式:2Na+O2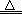 Na2O2~2 e-,其中失去电子与Na的物质的量之比等于关系式中的系数之比,则1molNa被完全氧化生成Na2O2时失去nA个电子,D项错误。
Na2O2~2 e-,其中失去电子与Na的物质的量之比等于关系式中的系数之比,则1molNa被完全氧化生成Na2O2时失去nA个电子,D项错误。
【考点定位】本题考查考生对物质的量、阿伏加德罗常数、氧气分子的电子数、气体摩尔体积、物质的量浓度等概念的了解;考查考生根据物质的量、质量、微粒数目、气体体积之间的相互关系进行有关计算的能力;考查考生对电解质的电离的了解;考生考生对常见氧化还原反应及其电子转移数的了解。
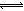 NH4++OH-,则n(NH4+)远远小于n(NH3?H2O),则N(NH4+)远远小于0.1nA,B项错误;盐酸是液体,不能用V÷22.4L/mol计算出其物质的量,且HCl是强酸,在水中能完全电离成氢离子和氯离子,不可能存在HCl分子,C项错误;由钠的性质可得:2Na+O2
NH4++OH-,则n(NH4+)远远小于n(NH3?H2O),则N(NH4+)远远小于0.1nA,B项错误;盐酸是液体,不能用V÷22.4L/mol计算出其物质的量,且HCl是强酸,在水中能完全电离成氢离子和氯离子,不可能存在HCl分子,C项错误;由钠的性质可得:2Na+O2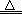 Na2O2,根据化合价升高总数等于失去电子数可得如下关系式:2Na+O2
Na2O2,根据化合价升高总数等于失去电子数可得如下关系式:2Na+O2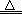 Na2O2~2 e-,其中失去电子与Na的物质的量之比等于关系式中的系数之比,则1molNa被完全氧化生成Na2O2时失去nA个电子,D项错误。
Na2O2~2 e-,其中失去电子与Na的物质的量之比等于关系式中的系数之比,则1molNa被完全氧化生成Na2O2时失去nA个电子,D项错误。【考点定位】本题考查考生对物质的量、阿伏加德罗常数、氧气分子的电子数、气体摩尔体积、物质的量浓度等概念的了解;考查考生根据物质的量、质量、微粒数目、气体体积之间的相互关系进行有关计算的能力;考查考生对电解质的电离的了解;考生考生对常见氧化还原反应及其电子转移数的了解。

练习册系列答案
相关题目
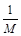 g
g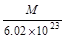 g
g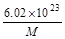 g
g