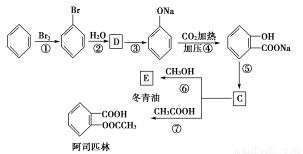
题目内容
已知某醇燃料含有碳、氢、氧三种元素。为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的氧气中燃烧,并使产生的气体全部通入如图所示的装置,得到如下表所列的实验结果(假设产生的气体完全被吸收):
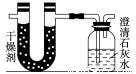
| 实验前 | 实验后 |
(干燥剂+U形管)的质量 | 101.1 g | 102.9 g |
(石灰水+广口瓶)的质量 | 312.0 g | 314.2 g |
根据实验数据求:
(1)实验完毕后,生成物中水的质量为________ g,
假设广口瓶里生成一种正盐,其质量为________ g;
(2)生成的水中氢元素的质量为________ g;
(3)生成的二氧化碳中碳元素的质量为________ g;
(4)该燃料中碳元素与氢元素的质量比为________;
(5)已知这种醇的每个分子中含有一个氧原子,则该醇的分子式为__________,结构简式为_______________________________。
(1)1.8 5 (2)0.2 (3)0.6 (4)3∶1
(5)CH4O CH3OH
【解析】(1)m(H2O)=102.9 g-101.1 g=1.8 g
m(CO2)=314.2 g-312.0 g=2.2 g
则n(CaCO3)=n(CO2)=0.05 mol
m(CaCO3)=5 g
(2)m (H)=m(H2O)×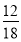 =1.8 g×
=1.8 g×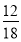 =0.2 g
=0.2 g
(3)m(C)=m(CO2)×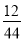 =2.2 g×
=2.2 g×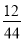 =0.6 g
=0.6 g
(4)m(C)∶m(H)=0.6 g∶0.2 g=3∶1
(5)该燃料分子中C、H的原子个数比为:
N(C)∶N(H)=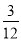 ∶
∶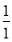 =1∶4。
=1∶4。
据碳四价的原则可知,当有机物分子中的碳氢原子个数比为1∶4时,分子中只能含CH4,而不能为CH4的整数倍,又因为每个分子中含有一个氧原子,则该醇的分子式为CH4O,结构简式为CH3OH。

 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案