题目内容
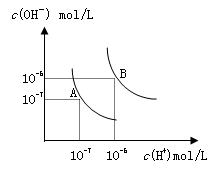
已知水在25℃和95℃时,其电离平衡曲线如图所示,下列说法错误的
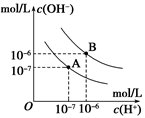

| A.A曲线代表25℃时水的电离平衡曲线 |
| B.当95℃时,pH=6的溶液呈中性 |
| C.25℃时,将10mLpH=12的NaOH溶液与1mLpH=1的H2SO4 溶液混合,所得溶液的pH=7 |
| D.95℃时,等体积等物质的量浓度的HA溶液和NaOH溶液混合后,当混合溶液的pH=6时,说明HA酸为弱酸 |
D
试题分析:A、A曲线上离子积Kw为10-14(mol?L?1)2,所以A曲线代表25℃时水的电离平衡曲线,正确;B、当95℃时,pH=6时,c(H+)=c(OH?)= 10-6mol?L?1,溶液呈中性,正确;C、10mLpH=12的NaOH溶液中OH-的物质的量为0.0001mol,1mLpH=1的H2SO4 溶液中H+的物质的量为0.0001mol,恰好完全反应,所得溶液的pH=7,正确;D、95℃时,等体积等物质的量浓度的HA溶液和NaOH溶液混合后,当混合溶液的pH=6时,反应后的溶液呈中性,说明HA为强酸,错误。

练习册系列答案
相关题目