题目内容
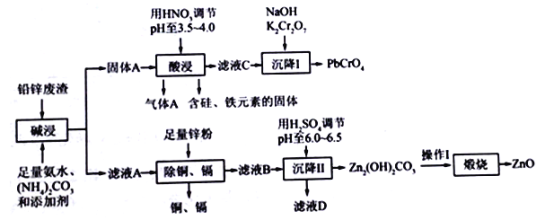
【题目】以工业制立德粉后的铅锌废渣(主要成分为ZnO和PbSO4,杂质含Si、Fe、Cu、Cd等元素)为原料,可以制活性氧化锌和黄色颜料铅铬黄,工业流程如图所示:
已知:Ksp(PbSO4)=1.6×10-8,Ksp(PbCO3)= 7.4×10-14
(1)“碱浸”过程中PbSO4发生反应的离子方程式为_________________________,气体A 的化学式为____________________。
(2)“酸浸”过程中pH不宜过低,若pH过低,可能出现的问题是___________________________。
(3)“沉降I”过程中发生反应的离子方程式为_____________________________________。
(4)滤液D中溶质的主要成分为_____________,为制得较为纯净的ZnO,“煅烧”之前应该进行的操作I是_____________________________。
(5)以1t含锌元素10%的铅锌废渣为原料,制得活性氧化锌113.4kg,依据以上数据_______(填“能”或“不能”)计算出锌元素的回收率。若能,写出计算结果,若不能,请说明理由________________________________________________。
【答案】 PbSO4 (s) + CO32─(aq) ![]() PbCO3(s) + SO42─ (aq) CO2 铁元素以离子形式进入到滤液C中,影响PbCrO4纯度 2Pb2++ 2OH─+Cr2O72─=2PbCrO4↓+H2O (NH4)2SO4 洗涤、干燥 不能 除去铜、镉的过程中添加了锌粉,最终ZnO中的锌元素不完全来自于铅锌废渣,无法计算铅锌废渣中锌元素的回收率
PbCO3(s) + SO42─ (aq) CO2 铁元素以离子形式进入到滤液C中,影响PbCrO4纯度 2Pb2++ 2OH─+Cr2O72─=2PbCrO4↓+H2O (NH4)2SO4 洗涤、干燥 不能 除去铜、镉的过程中添加了锌粉,最终ZnO中的锌元素不完全来自于铅锌废渣,无法计算铅锌废渣中锌元素的回收率
【解析】(1)已知Ksp(PbSO4)=1.6×10-8>Ksp(PbCO3)= 7.4×10-14.所以 “碱浸”过程中PbSO4发生反应的离子方程式为 PbSO4 (s) + CO32─(aq) ![]() PbCO3(s) + SO42─ (aq),固体A为PbCO3(s)
PbCO3(s) + SO42─ (aq),固体A为PbCO3(s)
酸浸后产生的气体为CO2, A 的化学式为CO2。答案:PbSO4 (s) + CO32─(aq) ![]() PbCO3(s) + SO42─ (aq) CO2
PbCO3(s) + SO42─ (aq) CO2
(2)“酸浸”过程中pH不宜过低,若pH过低,酸性强,使Fe与酸反应生成有关铁的化合物,进入到滤液C中,再加碱进行沉降时,会出现Fe(OH)3沉淀,影响PbCrO4纯度。答案:铁元素以离子形式进入到滤液C中,影响PbCrO4纯度。
(3)由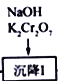 知“沉降I”过程中发生反应的离子方程式为. 2Pb2++2OH─+Cr2O72─=2PbCrO4↓+H2OO
知“沉降I”过程中发生反应的离子方程式为. 2Pb2++2OH─+Cr2O72─=2PbCrO4↓+H2OO
(4)由图知滤液B中含有的离子为Zn2- NH4+ CO32─ ,加H2SO4调节溶液的PH=6-6.5出现![]() 沉淀,滤液为(NH4)2SO4,所以滤液D中溶质的主要成分为(NH4)2SO4。
沉淀,滤液为(NH4)2SO4,所以滤液D中溶质的主要成分为(NH4)2SO4。
为制得较为纯净的ZnO,“煅烧”之前应该对固体进行洗涤干燥处理。答案:(NH4)2SO4 洗涤、干燥。
(5)根据图知不能,因为在除去铜、镉的过程中添加了锌粉,最终ZnO中的锌元素不完全来自于铅锌废渣,无法计算铅锌废渣中锌元素的回收率。