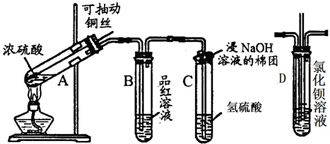
题目内容
向BaCl2溶液中通入SO2至饱和,此过程无明显实验现象.再向溶液中加入一种物质,溶液变浑浊.加入的这种物质不可能是( )
分析:由于亚硫酸的酸性比盐酸弱,向BaCl2溶液中通入SO2至饱和,没有发生反应,此过程无明显实验现象,SO2具有还原性,能被Fe3+离子氧化为SO42-离子,所以再向溶液中加入FeCl3溶液,生成BaSO4沉淀,SO2为酸性气体,与氨水反应生成SO32-离子,与BaCl2反应生成BaSO3沉淀,以此解答该题.
解答:解:A、SO2具有还原性,能被Fe3+离子氧化为SO42-离子,所以再向溶液中加入FeCl3溶液,生成BaSO4沉淀,故A不选;
B、BaCl2溶液中含有Cl-离子,加入AgNO3溶液生成AgCl沉淀.故B不选;
C、SO2为酸性气体,与氨水反应生成SO32-离子,SO32-离子与BaCl2反应生成BaSO3沉淀,故C不选;
D、NH4Cl溶液与BaCl2溶液、H2SO3都不反应,加入NH4Cl溶液后溶液中没有较多的SO42-离子或SO32-离子,则不会生成沉淀,故D选.
故选D.
B、BaCl2溶液中含有Cl-离子,加入AgNO3溶液生成AgCl沉淀.故B不选;
C、SO2为酸性气体,与氨水反应生成SO32-离子,SO32-离子与BaCl2反应生成BaSO3沉淀,故C不选;
D、NH4Cl溶液与BaCl2溶液、H2SO3都不反应,加入NH4Cl溶液后溶液中没有较多的SO42-离子或SO32-离子,则不会生成沉淀,故D选.
故选D.
点评:本题考查二氧化硫的化学性质,题目难度不大,注意二氧化硫的酸性和还原性的性质.

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案
相关题目
学生甲和学生乙完成了下列实验,其中实验现象完全相同的是( )
|
| A、选项A | B、选项B |
| C、选项C | D、选项D |
下列实验现象及相关的离子方程式均正确的是( )
| A、碳酸钙粉末中加入醋酸溶液,固体逐渐减少,生成无色气体:CaCO3+2H+?Ca2++CO2↑+H2O | ||
| B、向BaCl2溶液中通入SO2气体,出现白色沉淀:Ba2++SO2+H2O?BaSO3↓+2H+ | ||
C、向H2O2溶液中滴加酸化的KMnO4溶液,KMnO4溶液褪色:2MnO
| ||
D、将等物质的量浓度、等体积的Ba(OH)2溶液和NaHSO4溶液混合,生成白色沉淀:Ba2++SO
|
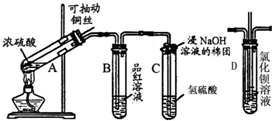 下列是与硫元素相关的一系列实验,根据图所示实验回答下列问题:
下列是与硫元素相关的一系列实验,根据图所示实验回答下列问题: