题目内容
3.为探索工业废料的再利用,某化学兴趣小组设计了如下实验流程,用含有铝、铁和铜的合金废料制取氯化铝、绿矾晶体(FeSO4•7H2O)和胆矾晶体.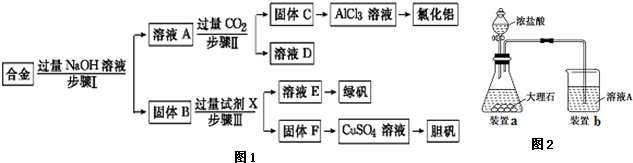
请回答:
(1)写出步骤Ⅱ反应的离子方程式:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.
(2)实际X是稀硫酸或H2SO4,步骤Ⅰ,Ⅱ,Ⅲ中均需进行的实验操作是过滤.
(3)进行步骤Ⅱ时,该小组用如图2所示装置及试剂将制得的CO2气体通入溶液A中.一段时间后,观察到烧杯中产生的白色沉淀逐渐减少,为了避免固体C减少,可采取的改进措施是在装置I和Ⅱ之间增加一个盛有饱和碳酸氢钠溶液的洗气瓶.
分析 铝、铁和铜的合金中只有金属铝可以和氢氧化钠之间反应生成溶液A偏铝酸钠,固体B是金属铁和金属铜,A中通入过量的二氧化碳可以得到氢氧化铝沉淀C和碳酸氢钠溶液D,金属铁可以和硫酸之间发生反应生成硫酸亚铁和氢气,但是金属铜和稀硫酸之间不反应,所以F是金属铜,硫酸亚铁溶液蒸发浓缩、冷却结晶可以获得绿矾晶体,金属铜可以获得胆矾晶体,
(1)过量CO2与偏铝酸钠溶液反应,生成氢氧化铝和碳酸氢根离子;
(2)固体B为铁和铜,根据流程加入X后溶解铁制备硫酸亚铁,则X为稀硫酸;不溶物与溶液分离的方法为过滤;
(3)制得的CO2气体中混有氯化氢气体,用饱和的碳酸氢钠除去;
解答 解:铝、铁和铜的合金中只有金属铝可以和氢氧化钠之间反应生成溶液A偏铝酸钠,固体B是金属铁和金属铜,A中通入过量的二氧化碳可以得到氢氧化铝沉淀C和碳酸氢钠溶液D,金属铁可以和硫酸之间发生反应生成硫酸亚铁和氢气,但是金属铜和稀硫酸之间不反应,所以F是金属铜,硫酸亚铁溶液蒸发浓缩、冷却结晶可以获得绿矾晶体,金属铜可以获得胆矾晶体,
(1)过量CO2与偏铝酸钠溶液反应,生成氢氧化铝和碳酸氢根离子,反应的离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,
故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(2)金属铁和金属铜不与氢氧化钠反应,金属铜和稀硫酸之间不反应,但是金属铁可以和稀硫酸之间反应生成硫酸亚铁和氢气,进而制的绿矾晶体,所以试剂X为稀硫酸;步骤Ⅰ、Ⅱ、Ⅲ均是固体和液体的分离操作,应该是过滤,
故答案为:稀硫酸或H2SO4;过滤;
(3)进行步骤Ⅱ时,该小组用如图2所示装置及试剂将制得的CO2气体通入溶液A中.一段时间后,观察到烧杯中产生的白色沉淀逐渐减少,其原因是二氧化碳气体中含有从盐酸中挥发出的氯化氢气体,氯化氢在水中溶解了部分沉淀氢氧化铝,发生的反应为Al(OH)3+3H+=Al3++3H2O,为了避免固体C减少,可在制取二氧化碳的收集装置中增加一个洗去氯化氢的装置,二氧化碳在饱和碳酸氢钠中不溶,氯化氢和碳酸氢钠反应生成二氧化碳气体,所以可在装置I和Ⅱ之间增加一个盛有饱和碳酸氢钠溶液的洗气瓶,除去二氧化碳中的氯化氢,
故答案为:在装置I和Ⅱ之间增加一个盛有饱和碳酸氢钠溶液的洗气瓶;
点评 本题考查物质制备方案的设计,题目难度中等,明确工艺流程原理是解答本题的关键,注意掌握物质制备方案的设计与评价原则,试题培养了学生的分析、理解能力及化学实验能力.

 阅读快车系列答案
阅读快车系列答案| A. | Ca2+、Na+、CO2- | B. | H+、Ca2+、HCO3- | C. | K+、Na+、NO3-、 | D. | NH4+、OH-、Cu2+ |
| A. | Fe、Mg、Al均能与空气中的氧气反应在表面生成致密的氧化膜,对内层金属有保护作用 | |
| B. | Fe在高温下能与水蒸气反应,Fe被氧化生成Fe3O4,H2O被还原生成H2 | |
| C. | 小苏打、氢氧化铝都可以用于中和胃酸 | |
| D. | 铝制餐具不适合长时间的蒸煮或长时间存放酸性、碱性或咸的食物 |
(I)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水.当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量(相当于25℃、101kPa下测得的热量).
(1)反应的热化学方程式为N2H4(g)+2H2O2(l)=N2(g)+4H2O(g)△H=-641.75kJ/mol.
(2)又已知H2O(l)=H2O(g)△H=+44kJ/mol.则16g液态肼与液态双氧水反应生成液态水时放出的热量是408.875kJ.
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是产物不会造成环境污染.
(II)某实验小组测定中和热做了三次实验,所用NaOH溶液的浓度为0.55mol•L-1,盐酸的浓度为0.5mol•L-1,每次取NaOH溶液和盐酸溶液各50mL,并记录如表原始数据.
| 实验序号 | 起始温度t1/℃ | 终止温度(t2)/℃ | 温差(t2-t1)/℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 28.3 | 3.3 |
| 2 | 25.1 | 25.1 | 25.1 | 28.4 | 3.3 |
| 3 | 25.1 | 25.1 | 25.1 | 28.5 | 3.4 |
(2)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热会偏小(填“偏大”、“偏小”或“不变”),其原因是用醋酸代替盐酸,醋酸电离要吸收能量,造成放出的能量偏小,所以测得的△H偏大,中和热偏小.
(3)在中和热测定实验中存在用水洗涤温度计上的盐酸溶液的步骤,若无此操作步骤,则测得的中和热偏小(填“偏大”、“偏小”或“不变”).
| A. | 22.4L | B. | 44.8L | C. | 89.6L | D. | 1120L |
| A. | 标准状况下,33.6L氟化氢中含有氟原子的数目为1.5NA | |
| B. | 标准状况下,22.4LSO3含有NASO3个分子 | |
| C. | 46gNO2和N2O4混合气体中含有原子总数为3NA | |
| D. | 常温常压下,0.1molCl2溶于水,转移的电子数目为0.1NA |

 肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成,NO2的二聚体N2O4则是火箭中常用氧化剂.试回答下列问题
肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成,NO2的二聚体N2O4则是火箭中常用氧化剂.试回答下列问题