题目内容
【题目】1mol氯化氢中含个氢原子,4.4g二氧化碳与g硫酸所含的分子数相等,它们所含氧原子数之比是 .
根据下列物质回答问题:①液态氯化氢 ②二氧化碳③氯化铁溶液 ④稀硫酸 ⑤金刚石,属于电解质的是:(填编号,下同),属于非电解质的是_.
【答案】NA;9.8;1:2;①;②
【解析】解:1mol氯化氢中含1molH原子,含有氢原子数目为NA,二氧化碳物质的量为 ![]() =0.1mol,二氧化碳与硫酸含有分子数目相等,则二者物质的量相等,硫酸的质量为0.1mol×98g/mol=9.8g,二者含有氧原子数目之比为2:4=1:2;
=0.1mol,二氧化碳与硫酸含有分子数目相等,则二者物质的量相等,硫酸的质量为0.1mol×98g/mol=9.8g,二者含有氧原子数目之比为2:4=1:2;
③氯化铁溶液、④稀硫酸 均属于混合物,⑤金刚石属于单质,①液态氯化氢属于化合物,在水溶液中可以导电,属于电解质,②二氧化碳属于化合物,属于共价化合物,其水溶液导电,不是二氧化碳电离的自由离子,是反应生成碳酸电离使溶液导电,属于非电解质,
故答案为:NA; 9.8;1:2;①;②.
此题是对化学计量、电解质、非电解质相关知识的考查。对化学计量,掌握相关计算公式是关键;电解质与非电解质的概念中,应注意其前提必须是化合物。另外,电解质溶液导电的原因,是自身电离产生自由移动的离子。

 全优点练单元计划系列答案
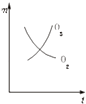
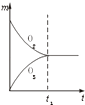
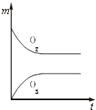
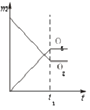
全优点练单元计划系列答案【题目】已知如表25℃时某些弱酸的电离平衡常数.如图表示常温时,稀释CH3COOH,HClO两种酸的稀溶液时,溶液pH随加水量的变化.依据所给信息,下列说法正确的是( )
CH3COOH | HClO | H2CO3 |
Ka=1.8×10﹣5 | Ka=3.0×10﹣8 | Ka1=4.4×10﹣7 Ka2=4.7×10﹣11 |
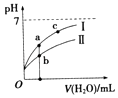
A.如图中的两种酸分别和等浓度的NaOH溶液刚好完全反应,消耗碱的体积相等
B.向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO﹣+CO2+H2O═2HClO+CO32﹣
C.a、b、c三点所示溶液中水的电离程度c>a>b
D.图象中,Ⅰ表示CH3COOH,Ⅱ表示HClO,且溶液导电性:c>b>a
【题目】在300mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g)Ni(CO)4(g),已知该反应平衡常数与温度的关系如表:
温度/℃ | 25 | 80 | 230 |
平衡常数 | 5×104 | 2 | 1.9×10﹣5 |
下列说法不正确的是( )
A.上述生成Ni(CO)4(g)的反应为放热反应
B.25℃时反应Ni(CO)4(g)Ni(s)+4CO(g)的平衡常数为2×10﹣5
C.80℃达到平衡时,测得n(CO)=0.3mol,则Ni(CO)4的平衡浓度为2 mol/L
D.在80℃时,测得某时刻,Ni(CO)4、CO浓度均为0.5 mol/L,则此时v(正)>v(逆)