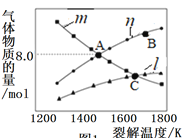
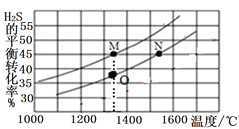
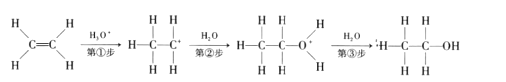
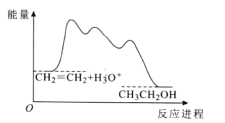
题目内容
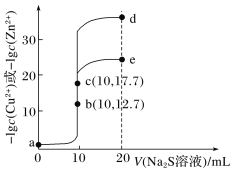
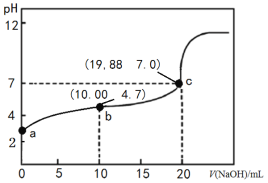
【题目】298K时,向20 mL 0.1000 mol·L-1 CH3COOH溶液中滴入0.1000 mol·L-1NaOH溶液,滴定曲线如图所示(忽略温度变化)。下列说法正确的是
A.该滴定过程应该选择石蕊溶液做指示剂
B.由c点数值可求醋酸的电离平衡常数为1.66×10-5 mol·L-1
C.b点溶液中各微粒浓度关系为2c(H+)+c(CH3COOH) =c(CH3COO-)+2c(OH-)
D.中和同体积同pH的醋酸和盐酸所用氢氧化钠的物质的量,后者多
【答案】BC
【解析】
A.由图可知,醋酸和氢氧化钠中和滴定的滴定终点为碱性,而石蕊的变色pH范围为5~8,不选其做指示剂,应选用酚酞做指示剂,A选项错误;
B.c点时,溶液呈中性,则有c(H+)=c(OH-),溶液中存在电荷守恒c(Na+)+c(H+)=c(OH-)+c(CH3COO-),则c(Na+)=c(CH3COO-)=![]() mol/L,c(CH3COOH)=
mol/L,c(CH3COOH)= ![]() mol/L,故醋酸的电离平衡常数
mol/L,故醋酸的电离平衡常数 ,B选项正确;
,B选项正确;
C.b点时的溶质为等量的CH3COOH和CH3COONa,存在着质子守恒2c(H+)+c(CH3COOH) =c(CH3COO-)+2c(OH-),C选项正确;
D.由于醋酸是弱电解质,在水溶液中部分电离,则相同体积、相同pH的醋酸和盐酸溶液前者物质的量更大,故中和同体积同pH的醋酸和盐酸所用氢氧化钠的物质的量,前者多,D选项错误;
答案选BC。

练习册系列答案
相关题目