题目内容
金属钠的化学性质很活泼,它在空气中很容易变质,可以与冷水发生剧烈反应.(1)钠在上述空气、冷水中发生反应中 (填“得”或“失”)电子,表现出 性(填“氧化”或“还原”).
(2)少量的金属钠应该保存在 中.
(3)写出钠与水反应的化学方程式 .
(4)当有0.2mol电子发生转移时,生成氢气的体积为 (标准状况)
【答案】分析:(1)钠在反应中易失电子作还原剂;
(2)钠和水、氧气易反应,保存钠时要隔绝水和氧气;
(3)钠和水反应生成氢氧化钠和氢气;
(4)根据氢气和转移电子之间的关系式计算氢气体积.
解答:解:(1)钠最外层有1个电子,所以钠在反应中易失电子作还原剂,体现还原性,故答案为:失,还原;
(2)钠和水、氧气易反应,保存钠时要隔绝水和氧气,钠的密度大于煤油密度且和煤油不反应,所以少量钠通常保存在煤油中,故答案为:煤油;
(3)钠和水反应生成氢氧化钠和氢气,反应方程式为:2Na+2H2O=H2↑+2NaOH,
故答案为:2Na+2H2O=H2↑+2NaOH;
(4)设生成氢气的体积为x.
2Na+2H2O=H2↑+2NaOH转移电子
22.4L 2mol
x 0.2mol
x=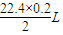 =2.24L,
=2.24L,
答:生成2.24L氢气.
点评:本题考查钠的性质,根据钠原子的最外层电子分析其性质,难度不大.
(2)钠和水、氧气易反应,保存钠时要隔绝水和氧气;
(3)钠和水反应生成氢氧化钠和氢气;
(4)根据氢气和转移电子之间的关系式计算氢气体积.
解答:解:(1)钠最外层有1个电子,所以钠在反应中易失电子作还原剂,体现还原性,故答案为:失,还原;
(2)钠和水、氧气易反应,保存钠时要隔绝水和氧气,钠的密度大于煤油密度且和煤油不反应,所以少量钠通常保存在煤油中,故答案为:煤油;
(3)钠和水反应生成氢氧化钠和氢气,反应方程式为:2Na+2H2O=H2↑+2NaOH,
故答案为:2Na+2H2O=H2↑+2NaOH;
(4)设生成氢气的体积为x.
2Na+2H2O=H2↑+2NaOH转移电子
22.4L 2mol
x 0.2mol
x=
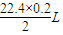 =2.24L,
=2.24L,答:生成2.24L氢气.
点评:本题考查钠的性质,根据钠原子的最外层电子分析其性质,难度不大.

练习册系列答案
相关题目
下面有关金属元素的描述不正确的是( )
| A、金属钠的化学性质很活泼,在自然界里不能以游离态存在 | B、金属镁和金属铝容易被空气氧化,所以在空气中必须进行密封保存 | C、金属铁可以和稀硫酸反应放出氢气,但冷的浓硫酸能用铁罐储存运输 | D、金属单质在化学反应中均作还原剂,不能作氧化剂 |