题目内容
工业上生产硫酸的原料,一种是黄铁矿,其主要成分为FeS2(S为-1价);另一种是磁黄铁矿,其主要成分是Fe1-xS(S为-2价),式中x通常为0.1~0.2,既含有Fe2+又含有Fe3+。
生产硫酸时将矿石煅烧,发生反应如下:
① 4 FeS2 + 11 O2→ 2 Fe2O3 + 8 SO2
② 4 Fe1-xS + (7-3x) O2→ 2 (1-x) Fe2O3 + 4 SO2
含FeS272%的黄铁矿10吨,理论上最多可以生产98%的浓硫酸 吨(矿石中无其他含硫物质)。
若磁黄铁矿Fe1-xS中x=0.1,则Fe1-xS中Fe2+与Fe3+的物质的量之比为 :1。
煅烧矿石时,为了尽可能地将矿石中的硫转变为SO2,需通入过量20%的空气(其中N2与O2的体积比为4:1,假设无其他气体成分),计算磁黄铁矿充分煅烧后排出的气体中SO2的体积分数(用含x的代数式表示)。
生产硫酸时将矿石煅烧,发生反应如下:
① 4 FeS2 + 11 O2→ 2 Fe2O3 + 8 SO2
② 4 Fe1-xS + (7-3x) O2→ 2 (1-x) Fe2O3 + 4 SO2
含FeS272%的黄铁矿10吨,理论上最多可以生产98%的浓硫酸 吨(矿石中无其他含硫物质)。
若磁黄铁矿Fe1-xS中x=0.1,则Fe1-xS中Fe2+与Fe3+的物质的量之比为 :1。
煅烧矿石时,为了尽可能地将矿石中的硫转变为SO2,需通入过量20%的空气(其中N2与O2的体积比为4:1,假设无其他气体成分),计算磁黄铁矿充分煅烧后排出的气体中SO2的体积分数(用含x的代数式表示)。
12 (2分) 3.5 (3分)  (3分)
(3分)
 (3分)
(3分)试题分析:(1)FeS2中S元素的含量是
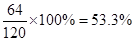
所以根据S原子守恒可知,最多可以生产98%的浓硫酸等质量为

(2)设Fe1-xS中Fe2+与Fe3+的物质的量分别是a和b
则根据原子守恒和电荷守恒可知a+b=0.9、2a+3b=2
解得a=0.7mol,b=0.2mol
所以Fe1-xS中Fe2+与Fe3+的物质的量之比为3.5︰1。
(3)设生成4mol SO2,则需要1.2 (7-3x)mol的O2,所需空气中的N2为4.8 (7-3x)mol;
反应后得到的混合气体组成为:SO2 4mol、O2 0.2 (7-3x)mol、N2 4.8 (7-3x)mol;
所以 SO2的体积分数

点评:该题以黄铁矿和磁黄铁矿生产浓硫酸为载体,重点考查学生对化学计算的熟悉掌握情况,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和规范的答题能力。该题的关键是在掌握反应原理的基础上利用好守恒法。

练习册系列答案
 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案
相关题目
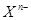 含中子N个,X的质量数为A,则ag X的氢化物中含质子的物质的量是
含中子N个,X的质量数为A,则ag X的氢化物中含质子的物质的量是 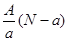 mol
mol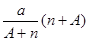 mol
mol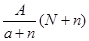 mol
mol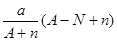 mol
mol )?之比为 ( )
)?之比为 ( )