��Ŀ����
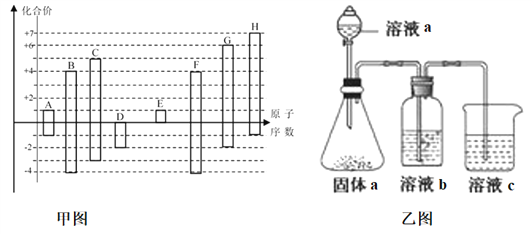
����Ŀ����ͼ�Dz��ֶ�����Ԫ�صij������ϼ���ԭ�������Ĺ�ϵͼ��
��ش��������⣺
��1��DԪ�������ڱ��е�λ��Ϊ___________��D��G�ļ��⻯���зе�ߵ���___________ ��д��ѧʽ����A��E�γɵĻ�����ĵ���ʽΪ_____________��
��2��D��E��G��H�ļ����Ӱ뾶�ɴ�С��˳��Ϊ__________________________�����û�ѧʽ��ʾ��
��3����Ԫ������X�Ǻ���CԪ�ص�18���ӷ��ӣ�1molX��l����25�� 101kPa����ȫȼ�շų�622kJ��������д����ʾXȼ���ȵ��Ȼ�ѧ����ʽ________________________________��
��4��H������������Ӧ��ˮ�����Ũ��Һ���ȶ������ȿɷֽ⣬����֮һ��H�ĵ��ʣ��ҵ���28mol����ת��ʱ�����¹�����9mol���壬д���÷�Ӧ�Ļ�ѧ����ʽ___________________________________��
��5��������Ԫ���еļ������a��b��c�����ʣ�ijͬѧ���ʵ������ͼװ��֤��Ԫ��B��C��F�ķǽ�����ǿ����������Һb����Һc��Ϊ��������
����Һa��b�ֱ�Ϊ________��________���ѧʽ����
����Һc�е����ӷ���ʽΪ__________________________________________��
�����ԭ�ӽṹ�ĽǶȽ��ͷǽ�����C��B��ԭ�� ____________________________________________________��
���𰸡� �ڶ����ڵ���A�� H2O ![]() S2->Cl->O2->Na+ N2H4(l)+O2(g)=N2(g)+2H2O(l) ��H=-622kJmol-1 4HClO4
S2->Cl->O2->Na+ N2H4(l)+O2(g)=N2(g)+2H2O(l) ��H=-622kJmol-1 4HClO4![]() 2Cl2��+7O2��+2H2O HNO3 ����NaHCO3 SiO32-+CO2+H2O=H2SiO3��+CO32- ̼�͵���Ԫ��λ��ͬһ���ڣ����Ӳ�����ͬ������̼��ԭ��������ԭ�Ӱ뾶С��ԭ�Ӻ˶��������ӵ���������ǿ�����Ե���̼�ķǽ�����ǿ
2Cl2��+7O2��+2H2O HNO3 ����NaHCO3 SiO32-+CO2+H2O=H2SiO3��+CO32- ̼�͵���Ԫ��λ��ͬһ���ڣ����Ӳ�����ͬ������̼��ԭ��������ԭ�Ӱ뾶С��ԭ�Ӻ˶��������ӵ���������ǿ�����Ե���̼�ķǽ�����ǿ
�������������������=�����������������=����������-8��F��O�����ۣ������ԭ��������С��ϵ��֪��AΪHԪ�ء�BΪCԪ�ء�CΪNԪ�ء�DΪOԪ�ء�EΪNaԪ����FΪSiԪ�ء�GΪSԪ�ء�HΪClԪ����
��1��DΪOԪ�أ���DԪ�������ڱ��е�λ��Ϊ���ڶ����ڵڢ�A�壻D��G�ļ��⻯��ֱ�Ϊ��H2O��H2S���е�ߵ���H2O��A��E�γɵĻ�����ΪNaH�������ӻ��������ʽΪ��![]() ��
��
��2��D��E��G��H�ļ����ӷֱ�Ϊ��O2-��Na+��S2-��Cl-��S2-��Cl-��3�����Ӳ㣬O2-��Na+ֻ��2�����Ӳ㣬���ݵ��Ӳ�Խ�࣬�뾶Խ���Ӳ�ṹ��ͬ��ԭ������Խ�뾶ԽС����D��E��G��H�ļ����Ӱ뾶�ɴ�С��˳��Ϊ��S2->Cl->O2->Na+��
��3��CΪNԪ�أ���NԪ�صĶ�Ԫ������X��18���ӷ��ӣ���XΪN2H4��������֪��������ʾN2H4ȼ���ȵ��Ȼ�ѧ����ʽΪ��N2H4(l)+O2(g)=N2(g)+2H2O(l) ��H=-622kJmol-1��
��4��H������������Ӧ��ˮ����ΪHClO4������֪��HClO4���ȷֽ����֮һ��Cl2�����ݵ���ת���غ��֪����Ԫ�ر�������������������ԭ���غ㣬����ˮ���ɣ�ClԪ�ػ��ϼ���+7��Ϊ0������28mol����ת��ʱ���õ�����Ϊ��28mol�£�7��2��=2mol����������Ϊ9mol-2mol=7mol����Ӧ����ʽΪ��4HClO4![]() 2Cl2��+7O2��+2H2O��
2Cl2��+7O2��+2H2O��
��5���ٷǽ�����ǿ��������������Ӧˮ���������ǿ���йأ�B��C��FԪ�طֱ�Ϊ��C��N��Si��������������Ӧ��ˮ����ֱ�Ϊ��H2CO3��HNO3��H2SiO3��������Һ�е�ǿ��������ԭ������ҺaΪHNO3������aΪNa2CO3����ҺbΪ����NaHCO3��Һ�����ڳ�ȥCO2�е�HNO3����ҺcΪNa2SiO3��Һ������Ϊ��ҺcΪNa2SiO3��Һ����ƿ�в�����CO2����Һb���������ձ���Na2SiO3��Һ��Ӧ����H2SiO3���������ӷ���ʽΪ��SiO32-+CO2+H2O=H2SiO3��+CO32-����BΪ̼Ԫ�ء�CΪ��Ԫ�أ�̼�͵���Ԫ��λ��ͬһ���ڣ����Ӳ�����ͬ������̼��ԭ��������ԭ�Ӱ뾶С��ԭ�Ӻ˶��������ӵ��������������õ�������ǿ�����Ե�Ԫ�صķǽ�����ǿ��̼Ԫ�ء�

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�