题目内容
某溶液中有 、Mg2+、Fe2+和Al3+四种离子,若向其中加入过量的氢氧化钠溶液,微热并搅拌,再加入过量盐酸,溶液中大量减少的阳离子是( )
、Mg2+、Fe2+和Al3+四种离子,若向其中加入过量的氢氧化钠溶液,微热并搅拌,再加入过量盐酸,溶液中大量减少的阳离子是( ) A. B.Mg2+ C.Fe2+ D.Al3+
B.Mg2+ C.Fe2+ D.Al3+
解析:![]() 遇OH-受热逸出NH3:
遇OH-受热逸出NH3:
![]() +OH-
+OH-![]() NH3↑+H2O,所以
NH3↑+H2O,所以![]() 的量减少。
的量减少。
Mg2+遇OH-生成Mg(OH)2沉淀,但遇H+又溶解生成Mg2+。即
Mg2++2OH-══Mg(OH)2↓
Mg(OH)2+2H+══Mg2++2H2O,所以Mg2+的量不变。
Fe2+与NaOH反应生成Fe(OH)2,Fe(OH)2不稳定,易被空气中O2氧化为Fe(OH)3加入盐酸后生成Fe3+,所以Fe2+的量减少。
Fe2++2OH-══Fe(OH)2↓
4Fe(OH)2+O2+2H2O![]() 4Fe(OH)3
4Fe(OH)3
Fe(OH)3+3H+══Fe3++3H2O
D选项,Al3+与过量NaOH反应生成NaAlO2,加入盐酸后又生成Al3+,所以Al3+的量不变。
Al3++4OH-══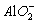 +2H2O
+2H2O
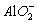 +4H+══Al3++2H2O
+4H+══Al3++2H2O
答案:AC

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
某溶液中有①NH4+②Mg2+③Fe2+④Al3+四种离子,若向其中加入过量的氢氧化钠溶液,加热并搅拌,再加入过量盐酸,溶液中大量减少的阳离子是( )
| A.只有① | B.只有③ | C.①③ | D.①②③④ |
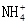 、Mg2+、Fe2+和Al3+四种离子,若向其中加入过量的氢氧化钠溶液,微热并搅拌,再加入过量盐酸,溶液中大量减少的阳离子是(双选)( )
、Mg2+、Fe2+和Al3+四种离子,若向其中加入过量的氢氧化钠溶液,微热并搅拌,再加入过量盐酸,溶液中大量减少的阳离子是(双选)( )