题目内容
1. 硫酸被称为是化学工业的发动机,硫酸的年产量可以作为衡量一个国家无机化学工业发展水平的标志,为提高经济效益,人类生产活动尽可能多功能化,共生工程将会大大促进化学工业的发展.
硫酸被称为是化学工业的发动机,硫酸的年产量可以作为衡量一个国家无机化学工业发展水平的标志,为提高经济效益,人类生产活动尽可能多功能化,共生工程将会大大促进化学工业的发展.以黄铁矿(主要成分为FeS2)为原料生产硫酸的工艺流程如图所示:
(1)设备A的名称为沸腾炉,图中吸收塔顶部a=98.
(2)A中发生反应的化学方程式为4FeS2+11O2 $\frac{\underline{\;高温\;}}{\;}$8SO2+2Fe2O3,接触室中发生反应的化学方程式是2SO2+O2$\frac{\underline{催化剂}}{△}$2SO3.
(3)工业生产中常用氨-硫酸法进行尾气脱硫,该法不仅能回收利用SO2,还能得到化肥,用两个化学方程式表示其反应原理SO2+2NH3•H2O═(NH4)2SO3、(NH4)2SO3+H2SO4═(NH4)2SO4+SO2↑+H2O.
分析 工业上生产硫酸主要分为造气、催化氧化、吸收三个阶段,造气主要用硫铁矿(FeS2)与氧气在高温条件下反应生成二氧化硫气体,生成的二氧化硫气体再与经过净化、干燥除去有害成分的空气一起通到催化反应室进行催化氧化生成三氧化硫,最后再用98%的硫酸溶液吸收三氧化硫制得发烟硫酸,再加水稀释得到浓硫酸;
(1)A的名称为沸腾炉;在吸收塔顶部用98%的硫酸溶液吸收三氧化硫制得发烟硫酸,再加水稀释得到浓硫酸;
(2)A中发生的反应为硫化亚铁和氧气反应生成二氧化硫和三氧化二铁;接触室中发生的反应为二氧化硫和氧气反应生成三氧化硫;
(3)工业生产中常用氨-酸法进行尾气脱硫,即先用氨水吸收二氧化硫生成亚硫酸盐,再用浓硫酸处理.
解答 解:工业上生产硫酸主要分为造气、催化氧化、吸收三个阶段,造气主要用硫铁矿(FeS2)与氧气在高温条件下反应生成二氧化硫气体,生成的二氧化硫气体再与经过净化、干燥除去有害成分的空气一起通到催化反应室进行催化氧化生成三氧化硫,最后再用98%的硫酸溶液吸收三氧化硫制得发烟硫酸,再加水稀释得到浓硫酸;
(1)A的名称为沸腾炉;在吸收塔顶部用98%的硫酸溶液吸收三氧化硫制得发烟硫酸,再加水稀释得到浓硫酸,故a=98,
故答案为:沸腾炉;98;
(2)A中发生的反应为硫化亚铁和氧气反应生成二氧化硫和三氧化二铁,故化学方程式为4FeS2+11O2 $\frac{\underline{\;高温\;}}{\;}$8SO2+2Fe2O3;接触室中发生的反应为二氧化硫和氧气反应生成三氧化硫,故化学方程式为2SO2+O2$\frac{\underline{催化剂}}{△}$2SO3;
故答案为:4FeS2+11O2 $\frac{\underline{\;高温\;}}{\;}$8SO2+2Fe2O3;2SO2+O2$\frac{\underline{催化剂}}{△}$2SO3;
(3)工业生产中常用氨-酸法进行尾气脱硫,即先用氨水吸收,再用浓硫酸处理,氨水吸收时,发生反应:SO2+2NH3•H2O═(NH4)2SO3,再用浓硫酸处理时,发生反应:(NH4)2SO3+H2SO4═(NH4)2SO4+SO2↑+H2O,以达到消除污染、废物利用的目的;
故答案为:SO2+2NH3•H2O═(NH4)2SO3;(NH4)2SO3+H2SO4═(NH4)2SO4+SO2↑+H2O.
点评 本题考查的知识点多,主要是工业接触法制硫酸的流程、原理、工业尾气的处理、化学方程式书写等,只有掌握相关的基础知识,解题并不困难,题目难度中等.

 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案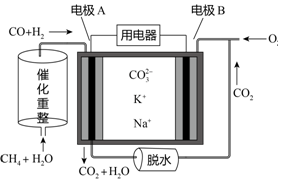
| A. | 电极A上H2和CO都发生了氧化反应 | |
| B. | 反应CH4+H2O$\frac{\underline{\;催化剂\;}}{△}$3H2+CO,每消耗1molCH4转移12mol电子 | |
| C. | 电池工作时,电能转变为化学能 | |
| D. | 电极B上发生的电极反应为:O2+2H2O+4e-═4OH- |
| A. | Cu | B. | NaCl溶液 | C. | KNO3 | D. | C2H5OH |
| 纯净物 | 混合物 | 强电解质 | 弱电解质 | 非电解质 | |
| A | 纯盐酸 | 水煤气 | 硫酸 | 醋酸 | 干冰 |
| B | 冰醋酸 | 空气 | 硫酸钡 | 亚硫酸 | 二氧化硫 |
| C | 氯气 | 盐酸 | 苛性钠 | 氢硫酸 | 碳酸钙 |
| D | 漂白粉 | 氨水 | 氯化钠 | 次氯酸 | 氯气 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 人类目前所直接利用的能量大部分是由化学反应产生的 | |
| B. | 化学反应一定伴随着能量变化 | |
| C. | 人体运动所消耗的能量与化学反应无关 | |
| D. | 植物的光合作用将太阳能转化为化学能 |
| A. | 正极附近硫酸根离子浓度增大 | |
| B. | 负极附近硫酸根离子浓度增大 | |
| C. | 正负极附近硫酸根离子浓度基本不变 | |
| D. | 若锌片、铜片同时有气泡冒出时,说明锌做正极 |
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
NO2+NO+2NaOH═2 NaNO2+H2O;2NO2+2NaOH═NaNO2+NaNO3+H2O
氨气也可以用来处理氮氧化物.例如,氨气与一氧化氮可发生如下反应:4NH3+6NO═5N2+6H2O
将一定量NO和NO2的混合气体通入300 mL 5mol/LNaOH溶液中,恰好被完全吸收.下列说法不正确的
( )
| A. | 原混合气体中NO在标准状况下的体积可能为16.8 L | |
| B. | 所得溶液中NaNO3和NaNO2的物质的量之比可能为1:2 | |
| C. | 若用氨气处理,所需氨气在标准状况下的体积可能为22.4 L | |
| D. | 在用氨气处理氮氧化物时,氮氧化物发生还原反应 |