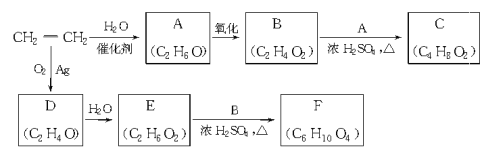
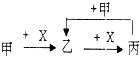题目内容
【题目】将10g铁粉置于40ml的HNO3溶液中,微热,反应随着HNO3浓度的降低生成气体的颜色由红棕色变为无色,充分反应后共收集标况下1792mlNO,NO2的混合气体,溶液中还残留了4.4g固体. 请回答下面问题,并写出计算过程.
(1)求该反应中被还原和未被还原的HNO3的物质的量之比
(2)求原HNO3溶液物质的量浓度
(3)求NO、NO2体积.
【答案】
(1)
解:溶于中残留固体为Fe,硝酸完全反应,Fe与硝酸反应生成Fe(NO3)2NO、NO2,未被还原的硝酸转化为Fe(NO3)2,
由Fe原子守恒可知n[Fe(NO3)2]= ![]() =0.1mol,则n未被还原(HNO3)=2n[Fe(NO3)2]=0.2mol,被还原的硝酸转化为NO、NO2,n被还原(HNO3)=n(NO+)+n(NO2)=
=0.1mol,则n未被还原(HNO3)=2n[Fe(NO3)2]=0.2mol,被还原的硝酸转化为NO、NO2,n被还原(HNO3)=n(NO+)+n(NO2)= ![]() =0.08mol,故反应中被还原和未被还原的HNO3的物质的量之比为:0.08mol:0.2mol=2:5,
=0.08mol,故反应中被还原和未被还原的HNO3的物质的量之比为:0.08mol:0.2mol=2:5,
答:反应中被还原和未被还原的HNO3的物质的量之比为2:5
(2)
解:根据N原子守恒,n(HNO3)=n未被还原(HNO3)+n被还原(HNO3)=0.2mol+0.08mol=0.28mol,则原HNO3溶液物质的量浓度为 ![]() =7mol/L,
=7mol/L,
答:原HNO3溶液物质的量浓度为7mol/L.
(3)
解:令混合气体中NO为xmol,NO2为ymol,
则有: ![]()
解得x=0.06、y=0.02
故标况下V(NO)=0.06mol×22.4L/mol=1.344L
V(NO2)=0.02mol×22.4L/mol=0.448L
答:标况下得到NO体积为1.344L,NO2体积为0.448L
【解析】(1)溶于中残留固体为Fe,硝酸完全反应,Fe与硝酸反应生成Fe(NO3)2NO、NO2 , 未被还原的硝酸转化为Fe(NO3)2 , 由Fe原子守恒可知Fe(NO3)2的物质的量,被还原的硝酸转化为NO、NO2 , 再根据N原子守恒计算;(2)根据N原子守恒计算HNO3的物质的量,进而计算原HNO3溶液物质的量浓度;(3)根据总体积、电子转移守恒列方程计算各自物质的量,再根据V=nVm计算体积.

【题目】下列各组物质按如图所示转化关系每一步都能一步实现的是( )
甲 | 乙 | 丙 | 丁 | |
A | FeCl3 | FeCl2 | Fe2O3 | Fe(OH)3 |
B | Cu | CuO | CuSO4 | CuCl2 |
C | SO2 | H2SO4 | SO3 | H2S |
D | Al(OH)3 | NaAlO2 | Al2O3 | AlCl3 |
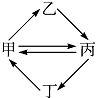
A.A
B.B
C.C
D.D