题目内容
现有常温下的四种溶液(如下表),下列有关叙述中正确的是( )
|
|
① |
② |
③ |
④ |
|
溶液 |
氨水 |
氢氧化钠溶液 |
醋酸 |
硫酸 |
|
pH |
11 |
11 |
3 |
3 |
A.在①、②中分别加入适量的氯化铵晶体后,①的pH减小,②的pH不变
B.V1L④与V2L②溶液混合后,若混合后溶液pH=4,则V1:V2=9:11
C.分别加水稀释10倍、四种溶液的pH:①>②>③>④
D.将①、④两种溶液等体积混合,所得溶液中:c (NH4+)>c(SO42-)>c(OH-)>c(H+)
【答案】
D
【解析】A项:在①中加入适量的氯化铵晶体后,氨根离子可抑制氨水的电离,碱性减弱,②中分别加入适量的氯化铵晶体后,强碱制弱碱,碱性减弱,pH均减小
B项:两溶液混合后呈酸性,故酸过得,则: 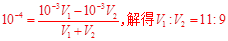
C项:稀释后酸的酸性减弱、碱的碱性减弱,但弱电解质在稀释过程中可促进其电离,故其酸碱性减弱的程度均略小,所以分别加水稀释10倍后四种溶液的pH:①>②>④>③
D项:pH之和为14的酸碱等体积混合,则谁弱呈谁性,所以最终溶液呈碱性,即c(OH-)>c(H+);又溶液主要是(NH4)2SO4,主要离子当然是c (NH4+)>c(SO42-),所以答案D正确

练习册系列答案
 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案
相关题目