题目内容
19.下列各组离子在指定溶液中可能大量共存的是B.A.无色透明的溶液:Fe3+、Cl-、NO3-、SO42-
B.加入铝粉能放出氢气的溶液:Mg2+、NH4+、K+、SO42-
C.由水电离出的c(H+)=1.0×10-12mol/L的溶液:Na+、K+、HCO3-、Cl-
D.含有大量ClO-的溶液:H+、Mg2+、I-、Cl-
E.含有大量HCO3-的溶液:AlO${\;}_{2}^{-}$、Mg2+、NH4+、Cl-
F.pH=1的无色溶液:NO${\;}_{3}^{-}$、Mg2+、NH${\;}_{4}^{+}$、SiO${\;}_{3}^{2-}$.
分析 A.无色透明的溶液中不存在有色离子,铁离子为有色离子;
B.加入铝粉能放出氢气的溶液为酸性或强碱性溶液,四种离子之间不反应,且都不与氢离子反应,在酸性溶液中能够共存;
C.由水电离出的c(H+)=1.0×10-12mol/L的溶液为酸性或碱性溶液,碳酸氢根离子能够与氢离子和氢氧根离子反应;
D.含有大量ClO-的溶液中次氯酸根离子能够与氢离子、碘离子反应;
E.含有大量HCO3-的溶液:,偏铝酸根离子能够与碳酸氢根离子、镁离子、铵根离子反应;
F.pH=1的无色溶液中存在大量氢离子,不存在有色离子,硅酸根离子与氢离子反应.
解答 解:A.无色透明的溶液中不存在有色的Fe3+,故A错误;
B.加入铝粉能放出氢气的溶液中存在大量氢离子或氢氧根离子,:Mg2+、NH4+、K+、SO42-之间不反应,都不与氢离子反应,在酸性溶液中可以大量共存,故B正确;
C.由水电离出的c(H+)=1.0×10-12mol/L的溶液中存在大量氢离子或氢氧根离子,HCO3-与氢离子和氢氧根离子反应,在溶液中一定不能大量共存,故C错误;
D.含有大量ClO-的溶液能够与H+、I-反应,在溶液中一定不能大量共存,故D错误;
E.含有大量HCO3-的溶液与:AlO2-与Mg2+、NH4+、HCO3-反应,在溶液中一定不能大量共存,故E错误;
F.pH=1的无色溶液中存在大量氢离子SiO32-与氢离子反应,在溶液中一定不能大量共存,故F错误;
故选B.
点评 本题考查离子共存的正误判断,为高考的高频题,题目难度中等,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.

 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案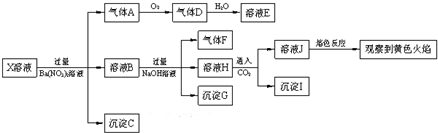
下列结论正确的是( )
| A. | X中肯定存在Na+、Fe2+、A13+、NH4+、SO42- | |
| B. | 气体F在足量氧气中经催化氧化不可直接生成气体D | |
| C. | 沉淀C一定是BaSO4、沉淀G一定是Fe(OH)3、沉淀I一定是Al(OH )3 | |
| D. | X中不能确定的离子是Fe2+、SO32-、K+和C1- |
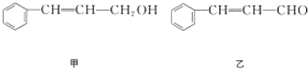
| 分子式 | C14H14O2 |
| 部分性质 | 能使Br2/CCl4褪色 |
| 能在稀H2SO4中水解 |
已知:RCH═CHR′$→_{ii,Zn/H_{2}O}^{i,O_{2}}$RCHO+R′CHO;2HCHO$→_{ii,H+}^{i,浓NaOH}$HCOOH+CH3OH,由乙制丙的一种合成路线图如图(A~F均为有机物,图中Mr表示相对分子质量):
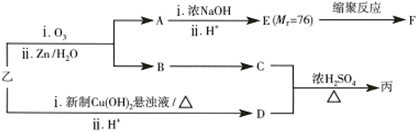
(1)试写出甲在一定条件下发生聚合反应的化学方程式:
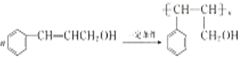 .
.(2)下列物质不能与C反应的是③(选填序号).
①金属钠 ②HBr ③Na2CO3溶液 ④乙酸
(3)写出F的结构简式:
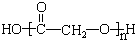 .
.(4)D有多种同分异构体,任写其中一种能同时满足下列条件的异构体的结构简式:
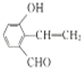 .
.a.苯环上连接着三种不同官能团 b.能发生银镜反应 c.能与Br2/CCl4发生加成反应 d.遇FeCl3溶液显示特征颜色
(5)综上分析,丙的结构简式为
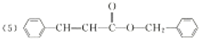 .
..
| A. | 甲醛 | B. | 食盐 | C. | 蔗糖 | D. | 味精 |
| A. | 25℃时,HA的电离平衡常数KHA=$\frac{1}{9}$ | |
| B. | 0.01mol/LBOH溶液中阳离子浓度比c(B+):c(H+)=1010:1 | |
| C. | 0.01mol/L的两溶液中水得电离度α:α(HA)=α(BOH) | |
| D. | 溶液混合时,V1=V2 |
