题目内容
肼(N2H4)是火箭发动机的一种燃料,反应时N2O4为氧化剂,生成N2和水蒸气。已知:N2(g)+2O2(g)=N2O4(g) ΔH="+8.7" kJ·mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH="-534.0" kJ·mol-1
下列表示肼跟N2O4反应的热化学方程式,正确的是 ( )
| A.2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)ΔH="-542.7" kJ·mol-1 |
| B.2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)ΔH="-1059.3" kJ·mol-1 |
C.N2H4(g)+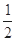 N2O4(g)= N2O4(g)=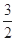 N2(g)+2H2O(g)ΔH="-1076.7" kJ·mol-1 N2(g)+2H2O(g)ΔH="-1076.7" kJ·mol-1 |
| D.2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)ΔH="-1076.7" kJ·mol-1 |
D
解析试题分析:2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) 可由N2H4(g)+O2(g)=N2(g)+2H2O(g) 乘以2再减去N2(g)+2O2(g)=N2O4(g)得到,所以ΔH="-534.0" *2-8.7="-1076.7" kJ·mol-1所以肼跟N2O4反应的热化学方程式为2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) ΔH="-1076.7" kJ·mol-1。ABC的表示都是错误的。
考点:热化学方程式
点评:本题考查了热化学方程式的书写,是对基础知识的考查,该题不难。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
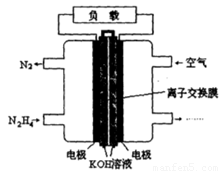
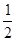 N2O4(g) ====
N2O4(g) ====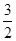 N2(g)+2H2O(g)ΔH="-1076.7" kJ·mol-1
N2(g)+2H2O(g)ΔH="-1076.7" kJ·mol-1