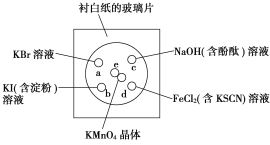
题目内容
【题目】如图是一个化学过程的示意图。已知甲池的总反应式为:
2CH3OH+3O2+4KOH 2K2CO3+6H2O
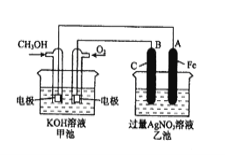
(1)请回答图中甲、乙两池的名称。甲电池是 装置,乙池是 装置。
(2)请回答下列电极的名称:通入CH3OH的电极名称是 ,B(石墨)电极的名称是 。
(3)写出电极反应式: 通入O2的电极的电极反应式是 。
(4)乙池中反应的化学方程式为 。
(5)当乙池中A(Fe)极的质量增加10.8g时,甲池中理论上消耗O2 mL(标准状况下)
【答案】(1)原电池(化学能转变为电能)(1分)
电解池(电能转变为化学能)(1分)
(2)负极,阳极(3)O2+2H2O+4e-=4OH-
(4)4AgNO4+2H2O![]() 4Ag+O2↑+4HNO3(3分)(5)560
4Ag+O2↑+4HNO3(3分)(5)560
【解析】
试题分析:(1)根据装置图可知,甲池是燃料电池,乙是电解池;
(2)根据2CH3OH+3O2+4KOH=2K2CO3+6H2O知,CH3OH发生氧化反应,则该电极是负极,石墨与原电池的正极相连,所以石墨电极是阳极;
(3)根据2CH3OH+3O2+4KOH=2K2CO3+6H2O知,O2得电子和水反应生成氢氧根离子,发生还原反应,电极反应为O2+2H2O+4e-=4OH-;
(4)乙池中离子放电顺序为:阳离子 Ag+>H+,阴离子OH->NO3 -,所以电池反应式为4AgNO3+2H2O![]() 4Ag+O2↑+4HNO3;
4Ag+O2↑+4HNO3;
(5)根据得失电子数相等,氧气与银的关系式为:O2~4Ag,则氧气的体积=![]() ×22.4L/mol=0.56L=650mL。
×22.4L/mol=0.56L=650mL。

练习册系列答案
 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案
相关题目