题目内容
某课外小组设计了下图所示的实验装置(图中固定装置已略去),进行SO2性质的研究.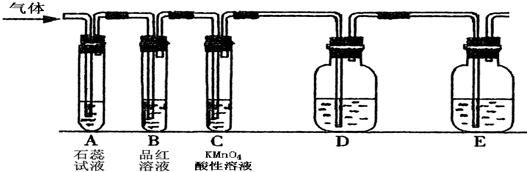
(1)从物质分类的角度,SO2属于
①图中D装置可用来验证SO2具有该性质,其中所加入的试剂是
②当向该装置通入SO2时,A中紫色石蕊溶液变红,用化学用语解释其原因是
(2)从元素化合价的角度分析,SO2具有
①当向该装置通入SO2 一段时间后,可观察C中溶液褪色,说明SO2具有
②如验证SO2还具有另一方面的性质,可选择的药品是
A.过氧化氢 B. 浓硫酸 C.氯水 D.硫化钠溶液.
分析:(1)能和碱反应只生成盐和水的氧化物为酸性氧化物;
①要证明二氧化硫为酸性氧化物,则必须和碱反应;
②酸能使紫色石蕊试液变红色;
(2)二氧化硫中硫元素化合价处于中间价态,应该具有氧化性和还原性;二氧化硫能被强氧化剂氧化,也能被强还原剂还原.
①要证明二氧化硫为酸性氧化物,则必须和碱反应;
②酸能使紫色石蕊试液变红色;
(2)二氧化硫中硫元素化合价处于中间价态,应该具有氧化性和还原性;二氧化硫能被强氧化剂氧化,也能被强还原剂还原.
解答:解:(1)二氧化硫和碱反应只生成盐和水,所以为酸性氧化物,故答案为:酸性;
①要验证二氧化硫属于酸性氧化物,必须和碱反应,如氢氧化钠,二氧化硫和氢氧化钠反应生成亚硫酸钠,亚硫酸钠溶液和氢氧化钠溶液都是无色溶液,所以反应现象不明显,可以向溶液中加入酚酞试液检验亚硫酸钠的生成,则D中盛放的液体是滴加酚酞的氢氧化钠稀溶液,故答案为:滴加酚酞的NaOH稀溶液;
②二氧化硫和水反应生成亚硫酸,亚硫酸能电离出氢离子而使其溶液呈酸性,紫色石蕊试液遇酸变红色,所以紫色石蕊试液变红色,其反应方程式为:H2O+SO2?H2SO3,
故答案为:H2O+SO2?H2SO3,亚硫酸能电离出氢离子而使其溶液呈酸性,酸与紫色石蕊试液变红色;
(2)二氧化硫中硫元素的化合价为+4价,属于中间价态,中间价态的元素能失电子也能得电子,所以具有氧化性和还原性,故答案为:氧化和还原;
①酸性高锰酸钾具有强氧化性,能氧化二氧化硫生成硫酸,该反应中二氧化硫作还原剂,所以二氧化硫具有还原性,反应方程式为:5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO4,
故答案为:还原;5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO4;
②要证明二氧化硫的氧化性,二氧化硫必须和还原性物质发生氧化还原反应,
A.过氧化氢具有氧化性,能氧化二氧化硫,故错误;
B.浓硫酸具有强氧化性,且和二氧化硫不反应,故错误;
C.氯水具有强氧化性,能氧化二氧化硫,故错误;
D.硫化钠具有还原性,能被二氧化硫氧化,故正确;
故选D.
①要验证二氧化硫属于酸性氧化物,必须和碱反应,如氢氧化钠,二氧化硫和氢氧化钠反应生成亚硫酸钠,亚硫酸钠溶液和氢氧化钠溶液都是无色溶液,所以反应现象不明显,可以向溶液中加入酚酞试液检验亚硫酸钠的生成,则D中盛放的液体是滴加酚酞的氢氧化钠稀溶液,故答案为:滴加酚酞的NaOH稀溶液;
②二氧化硫和水反应生成亚硫酸,亚硫酸能电离出氢离子而使其溶液呈酸性,紫色石蕊试液遇酸变红色,所以紫色石蕊试液变红色,其反应方程式为:H2O+SO2?H2SO3,
故答案为:H2O+SO2?H2SO3,亚硫酸能电离出氢离子而使其溶液呈酸性,酸与紫色石蕊试液变红色;
(2)二氧化硫中硫元素的化合价为+4价,属于中间价态,中间价态的元素能失电子也能得电子,所以具有氧化性和还原性,故答案为:氧化和还原;
①酸性高锰酸钾具有强氧化性,能氧化二氧化硫生成硫酸,该反应中二氧化硫作还原剂,所以二氧化硫具有还原性,反应方程式为:5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO4,
故答案为:还原;5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO4;
②要证明二氧化硫的氧化性,二氧化硫必须和还原性物质发生氧化还原反应,
A.过氧化氢具有氧化性,能氧化二氧化硫,故错误;
B.浓硫酸具有强氧化性,且和二氧化硫不反应,故错误;
C.氯水具有强氧化性,能氧化二氧化硫,故错误;
D.硫化钠具有还原性,能被二氧化硫氧化,故正确;
故选D.
点评:本题考查了二氧化硫的探究实验,明确实验原理是解本题关键,根据二氧化硫中硫元素的化合价确定二氧化硫的氧化性和还原性,根据二氧化硫和碱的反应确定为酸性氧化物,知道二氧化硫的检验方法,注意二氧化硫的漂白性和次氯酸漂白性的不同,题目难度不大.

练习册系列答案
相关题目