题目内容
在2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O反应中( )
| A.氧化产物与还原产物的物质的量之比为2∶5 |
| B.氧化产物与还原产物的物质的量之比为5∶2 |
| C.氧化剂与还原剂的物质的量之比为1∶8 |
| D.氧化剂与还原剂的物质的量之比为5∶1 |
B
试题分析:根据方程式可知,Mn元素的化合价从+7价降低到+2价,得到2个电子。氯元素的化合价从-1价升高到0价,失去1个电子。所以根据电子的得失守恒可知,氧化剂与还原剂的物质的量之比为1∶5,氧化产物与还原产物分别是氯气和氯化锰,所以二者的物质的量之比为5∶2,答案选B。
点评:在进行氧化还原反应的计算时,需要利用好电子的得失守恒这一关系式。

练习册系列答案
相关题目
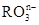 和氟气可发生如下反应:
和氟气可发生如下反应: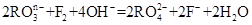 ,从而可知在
,从而可知在 ,若反应后
,若反应后 变成
变成 ,且反应中氧化剂与还原剂的离子个数比为5:2,则R2O8n-中R元素的化合价以及n分别为
,且反应中氧化剂与还原剂的离子个数比为5:2,则R2O8n-中R元素的化合价以及n分别为