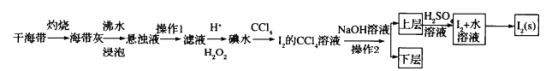
题目内容
【题目】已知反应:①101kPa时,2C(s)+O2(g)=2CO(g) ΔH=-221kJ·mol-1
②稀溶液中,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ·mol-1
③H2(g)+![]() O2(g)=H2O(g) ΔH=-241.8kJ·mol-1
O2(g)=H2O(g) ΔH=-241.8kJ·mol-1
④H2O(g)=H2O(l) ΔH=-44.0kJ·mol-1
下列结论正确的是( )
A.碳的燃烧热大于110.5kJ·mol-1
B.浓硫酸与稀NaOH溶液反应生成1mol水,放出57.3kJ 热量
C.氢气的燃烧热为241.8kJ·mol-1
D.2H2(g)+O2(g)=2H2O(l)的反应热为ΔH=571.6kJ·mol-1
【答案】A
【解析】
A. CO继续在氧气中燃烧生成二氧化碳还会放出热量;
B. 浓硫酸稀释放出大量的热;
C. 燃烧热是指1mol纯物质完全燃烧生成稳定的氧化物时所释放的热量;
D. 氢气在氧气中燃烧的反应是放热反应。
A. 由反应①可知,1mol碳燃烧生成CO放出的热量为110.5 kJ,CO燃烧生成CO2继续放出热量,故1mol碳完全燃烧放出的热量大于
110.5 kJ,所以碳的燃烧热大于110.5 kJ / mol,A正确;
B. 浓硫酸的稀释要放出大量的热量,所以放出的热量大于57.3 kJ,所以浓硫酸与NaOH溶液反应生成1mol 水,放出热量大于57.3 kJ,B错误;
C. 燃烧热是指1mol纯物质完全燃烧生成稳定的氧化物时所释放的热量,根据热化学反应方程式③和④可计算出氢气的燃烧热为:![]() ,C错误;
,C错误;
D. 根据热化学反应方程式③和④得出:![]() 由此可以得到:
由此可以得到:![]() ,D错误。
,D错误。
燃烧热 | 中和热 | ||
相同点 | 能量变化 | 放热反应 | |
|
| ||
不同点 | 反应物的量 |
| 不限量 |
生成物的量 | 不限量 |
| |
反应热的定义 | 在101 kPa时,1mol纯物质完全燃烧生成稳定的氧化物时所释放的热量 | 强酸强碱的稀溶液完全中和生成 | |