题目内容
室温时,0.1 mol·L-1的HA 溶液的pH=3,向该溶液中逐滴加入NaOH,在滴加过程中,有关叙述正确的是
A.原HA溶液中,c(H+)=c(OH-)+c(A-)
B.当滴入少量的NaOH,促进了HA的电离,溶液的pH降低
C.当恰好完全中和时,溶液呈中性
D.当NaOH溶液过量时,可能出现:c(A-)>c(Na+)>c(OH-)>c(H+)
【答案】
A
【解析】
试题分析:0.1 mol·L-1的HA 溶液的pH=3,可知HA是弱酸,在水溶液中发生电离的方程式为:HA A-+H+。B项:加入NaOH,OH-与H+反应,促进了HA的电离,溶液的pH升高,故B错。C项:当恰好完全中和时,溶质为NaA,NaA是强碱弱酸盐,水解溶液呈碱性,故C错。D项:c(A-)>c(Na+)>c(OH-)>c(H+),这个关系式,c(A-)+c(OH-)>c(Na+)+c(H+)违反了电荷守恒,即不符合电荷总数为O,不可能出现这种情况,故D错。故选A。
A-+H+。B项:加入NaOH,OH-与H+反应,促进了HA的电离,溶液的pH升高,故B错。C项:当恰好完全中和时,溶质为NaA,NaA是强碱弱酸盐,水解溶液呈碱性,故C错。D项:c(A-)>c(Na+)>c(OH-)>c(H+),这个关系式,c(A-)+c(OH-)>c(Na+)+c(H+)违反了电荷守恒,即不符合电荷总数为O,不可能出现这种情况,故D错。故选A。
考点:弱酸的电离 盐类的水解
点评:注意弱酸的在水溶液中不完全电离;盐类的水解中“谁若谁水解,谁强显谁性”,水溶液中的离子电荷守恒。

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
化学中图象可以直观地描述化学反应的进程或结果,下列图象描述正确的是( )
A、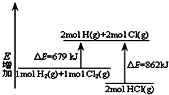 表示化学反应H2(g)+Cl2(g)=2HCl(g)的能量变化,则该反应的反应热△H=183 kJ?mol-1 | B、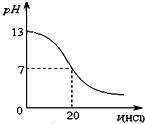 表示室温时用0.1 mol?L-1盐酸滴定20 mL 0.1 mol?L-1NaOH溶液,溶液pH随加入酸体积变化 | C、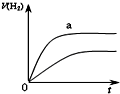 表示体积和pH均相同的HCl和CH3COOH两种溶液中,分别加入足量的锌,产生H2的体积随时间的变化,则a表示CH3COOH溶液 | D、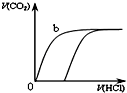 表示10 mL 0.1mol/L Na2CO3和NaHCO3两种溶液中,分别滴加0.1mol/L HCl,产生CO2的体积随盐酸体积的变化,则b表示Na2CO3溶液 |