题目内容
下列分子或离子的空间构型为平面三角形的是( )
| A.NO | B.NH3 | C.H3O+ | D.CO2 |
A
试题分析:根据价层电子对互斥理论可知,选项ABCD中中心原子含有的孤对电子对数分别是(5+1-3×2)÷2=0、(5-3×1)÷2=1、(6-1-3×1)÷2=1、(4-2×2)÷2=0,所以选项ABCD分别是平面三角形结构、三角锥形结构、三角锥形结构、直线型结构,答案选A。
点评:该题是基础性试题的考查,试题注重基础知识的巩固和训练。该题的关键是利用好价层电子对互斥理论,准确判断出中心原子含有的孤对电子对数,然后灵活运用即可,有利于培养学生的逻辑推理和抽象思维能力。

练习册系列答案
相关题目
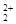 与互为等电子体,O22+的电子式可表示为 ;
与互为等电子体,O22+的电子式可表示为 ;
 N放出942 kJ热量,根据以上信息和数据,下列说法正确的是( )
N放出942 kJ热量,根据以上信息和数据,下列说法正确的是( )