��Ŀ����
����Ŀ��KClO3��Ũ������һ���¶��·�Ӧ�����ɻ���ɫ���ױ���������ȣ���仯�ɱ���Ϊ��2KClO3+4HCl��Ũ���T2KCl+2ClO2��+Cl2��+2H2O�� a��������÷�Ӧ�е���ת�Ƶ������˫���ŷ���ʾ���� ��
b�����������뻹ԭ��������ʵ���֮��Ϊ
c��Ũ�����ڷ�Ӧ����ʾ������������ �� ����д��ţ�
��ֻ�л�ԭ�ԣ��ڻ�ԭ�Ժ����ԣ���ֻ�������ԣ��������Ժ����ԣ�
d������0.1mol Cl2 �� ��ת�Ƶĵ��ӵ����ʵ���Ϊmol��
���𰸡� ��1��2���ڣ�0.2
��1��2���ڣ�0.2
���������⣺a��KClO3��ClԪ�صĻ��ϼ۴�+5�۽��͵�0�ۣ���5�����ӣ�HClʧȥ5�����ӣ������ת�Ƶķ������ĿΪ 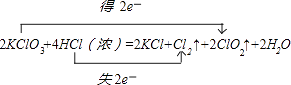 �ʴ�Ϊ��
�ʴ�Ϊ�� 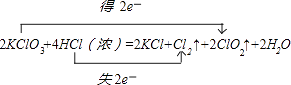 ��
��
b����Ӧ��KClO3Ϊ�����������Ի�ԭ����Ϊ�������ȣ�HClΪ��ԭ������������Ϊ���������������뻹ԭ��������ʵ���֮��Ϊ1��2��
�ʴ�Ϊ��1��2��
c����Ӧ2KClO3+4HCl��Ũ��=2KCl+Cl2��+2ClO2��+2H2O�У�HCl����Ԫ�ػ��ϼ��ɩ�1������ΪCl2��0�ۿ�֪��HCl����Ԫ�ر�������HCl�ڷ�Ӧ�л�ԭ����������ã�����һ�룮
��ѡ���ڣ�
d����Ӧ��ֻ��Cl2���������HCl����Ԫ�ػ��ϼ��ɩ�1������ΪCl2��0�ۣ����Բ���0.1molCl2 �� ת�Ƶĵ��ӵ����ʵ���Ϊ0.1mol��2=0.2mol��
�ʴ�Ϊ��0.2mol��
a��KClO3��ClԪ�صĻ��ϼ۴�+5�۽��͵�0�ۣ���5�����ӣ�HClʧȥ5�����ӣ�
b����Ӧ��KClO3Ϊ�����������Ի�ԭ����Ϊ�������ȣ�HClΪ��ԭ������������Ϊ������
c����Ӧ2KClO3+4HCl��Ũ��=2KCl+Cl2��+2ClO2��+2H2O�У�HCl����Ԫ�ػ��ϼ��ɩ�1������ΪCl2��0�ۿ�֪��HCl����Ԫ�ر�������HCl�ڷ�Ӧ�л�ԭ����������ã�����һ�룻
d����Ӧ��ֻ��Cl2���������HCl����Ԫ�ػ��ϼ��ɩ�1������ΪCl2��0�ۣ��ݴ˼���ת�Ƶ������ʵ�����

 �ظ���ʦ�㲦ϵ�д�
�ظ���ʦ�㲦ϵ�д�