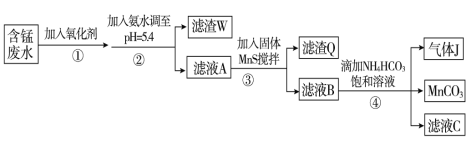
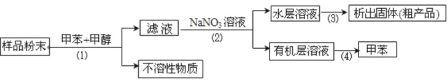
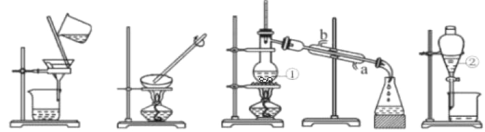
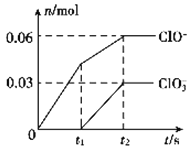
题目内容
【题目】研究CO2与CH4的反应使之转化为CO和H2,对减缓燃料危机,减少温室效应具有重要的意义。
(1)已知:①2CO(g)+O2(g)=2CO2(g)ΔH=-566kJ·mol-1
②2H2(g)+O2(g)=2H2O(g)ΔH=-484kJ·mol-1
③CH4(g)+2O2(g)=CO2(g)+2H2O(g)ΔH=-802kJ·mol-1
则CH4(g)+CO2(g)=2CO(g)+2H2(g)ΔH= kJ·mol-1。
(2)在密闭容器中通入物质的量浓度均为0.1 mol·L-1的CH4与CO2在一定条件下发生反应 CH4(g)+CO2(g)=2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如图
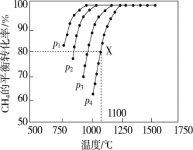
据图可知,p1、p2、p3、p4由大到小的顺序是 。在压强为p4、1100 ℃的条件下,该反应在5 min时达到平衡点X,该温度下,反应的平衡常数为 。
(3)CO和H2在工业上还可以通过反应C(s)+H2O(g)![]() CO(g)+H2(g)来制取。
CO(g)+H2(g)来制取。
①在恒温恒容下,如果从反应物出发建立平衡,可认定反应已达到平衡的是__________。
A.体系压强不再变化 B.H2与CO的物质的量之比为1∶1
C.混合气体的密度保持不变 D.气体平均相对分子质量为15,且保持不变
②在某密闭容器中同时投入四种物质,2 min时达到平衡,测得容器中有1 mol H2O(g)、1 mol CO(g)、2.2 molH2(g)和一定量的C(s),若此时对体系加压,则平衡向 (填“正”或“逆”)反应方向移动,第5 min时达到新的平衡,请在右图中画出2~5 min容器中气体平均相对分子质量的变化曲线。
【答案】
(1)+248;
(2)P4>P3>P2>P1;1.64;
(3)①AC;
②逆; 。
。
【解析】
试题分析:(1)已知反应①2CO(g)+O2(g)═2CO2(g)△H=-566kJmol-1,
②2H2(g)+O2(g)═2H2O(g)△H=-484kJmol-1,
③CH4(g)+2O2(g)═CO2(g)+2H2O(g) △H=-802kJmol-1,
根据盖斯定律,将③-①-②可得:CH4(g)+CO2(g)2CO(g)+2H2(g)
△H=(-802kJmol-1)-(-566kJmol-1) -(-484kJmol-1)=+248KJ/mol,故答案为:+248;
(2)由图可知,温度一定时,甲烷的转化率α(P1)>α(P2)>α(P3)>α(P4),该反应正反应是气体体积增大的反应,增大压强平衡向逆反应进行,甲烷的转化率降低,故压强P4>P3>P2>P1;由图1可知,压强为P4、1100℃的条件下,该反应5min时达到平衡X点,是甲烷的转化率为80%,甲烷的浓度变化量为0.1mol/L×80%=0.08mol/L,
CH4(g)+CO2(g) ![]() 2CO(g)+2H2(g),
2CO(g)+2H2(g),
开始(mol/L):0.1 0.1 0 0
变化(mol/L):0.08 0.08 0.16 0.16
平衡(mol/L):0.02 0.02 0.16 0.16
故该温度下平衡常数k=![]() =1.64,故答案为:P4>P3>P2>P1;1.64;
=1.64,故答案为:P4>P3>P2>P1;1.64;
(3)①A、正反应方向是个气体体积增大的方向,故随着反应的进行,平衡之前,体系压强会增大,故一旦当体系压强不变,说明反应达平衡,故A正确;B、CO与H2的化学计量数为1:1,反应数值按物质的量比为1:1进行,不能说明到达平衡,故B错误;C、混合气体的密度ρ=![]() ,容器恒容,即V不变,随着反应的进行,混合气体的质量m增大,故ρ增大,一旦当ρ不变时,说明反应达平衡,故C正确;D、反应混合物的总质量不变,随反应进行,反应混合物的总的物质的量增大,平均相对分子质量减小,混合气体的平均相对分子质量不发生变化,说明到达平衡,但达平衡时,平均相对分子质量不一定是15,故D错误;故选AC;
,容器恒容,即V不变,随着反应的进行,混合气体的质量m增大,故ρ增大,一旦当ρ不变时,说明反应达平衡,故C正确;D、反应混合物的总质量不变,随反应进行,反应混合物的总的物质的量增大,平均相对分子质量减小,混合气体的平均相对分子质量不发生变化,说明到达平衡,但达平衡时,平均相对分子质量不一定是15,故D错误;故选AC;
②根据勒沙特列原理可知,增大压强,平衡向着气体体积减小的方向移动,此反应的逆反应方向是个气体体积减小的方向,故增大压强,向逆反应方向移动;在第2min时,混合气体的平均相对分子质量即平均摩尔质量![]() =
=![]() =
=![]() =12g/mol。设在第2~5min期间的任何时刻,有XmolH2被消耗,则有:
=12g/mol。设在第2~5min期间的任何时刻,有XmolH2被消耗,则有:
C(s)+H2O(g)CO(g)+H2(g/span>)
初始量(mol)1 1 2.2
转变量(mol)X X X
剩余量(mol)(1+X) (1-X) (2.2-X)
混合气体的平均相对分子质量即平均摩尔质量![]() =
=![]() =
=![]() =12,故可知在2~5min期间的任意时刻,混合气体的平均相对分子质量不变,一直是12,故可得2~5min内容器中气体平均相对分子质量的变化曲线为
=12,故可知在2~5min期间的任意时刻,混合气体的平均相对分子质量不变,一直是12,故可得2~5min内容器中气体平均相对分子质量的变化曲线为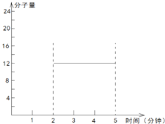 ,故答案为:逆;
,故答案为:逆;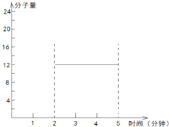 。
。

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案