题目内容
工业上利用硫铁矿烧渣(主要成分为Fe2O3、FeO、SiO2等)为原料制备高档颜料铁红(Fe2O3 ),具体生产流程如下: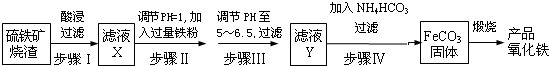
试回答下列问题:
(1)滤液X中含有的金属阳离子是
(2)步骤Ⅲ中可选用
A.稀硝酸 B.氨水 C.氢氧化钠溶液 D.高锰酸钾溶液
(3)步骤Ⅳ中,FeCO3 达到沉淀溶解平衡时,室温下测得溶液的pH为8,c(Fe2+)为1.0×10-5mol?L-1.试判断所得FeCO3 中是否混有Fe(OH)2
(4)步骤Ⅳ的反应温度一般需控制在35℃以下,其目的是
(5)在空气中煅烧FeCO3 生成产品氧化铁的化学方程式为
分析:(1)硫铁矿烧渣主要成分为Fe2O3、FeO、SiO2等,依据酸浸后铁的氧化物和酸反应溶解,二氧化硅不与酸反应分析判断;
(2)依据步骤Ⅱ加入过量铁粉滤液中阳离子为亚铁离子,步骤Ⅲ加入试剂调节溶液PH至5-6.5,试剂不能氧化亚铁离子,不能是碱性强的溶液;
(3)依据浓度商和溶度积常数比较分析判断,Q<Ksp沉淀溶解,Q>Ksp沉淀溶解,Q=Ksp沉淀溶解达到平衡;
(4)温度过高碳酸氢铵会分解,温度升高促进亚铁离子的水解;
(5)空气中煅烧碳酸亚铁,是碳酸亚铁和氧气反应生成氧化铁和二氧化碳,原子守恒配平写出;
(2)依据步骤Ⅱ加入过量铁粉滤液中阳离子为亚铁离子,步骤Ⅲ加入试剂调节溶液PH至5-6.5,试剂不能氧化亚铁离子,不能是碱性强的溶液;
(3)依据浓度商和溶度积常数比较分析判断,Q<Ksp沉淀溶解,Q>Ksp沉淀溶解,Q=Ksp沉淀溶解达到平衡;
(4)温度过高碳酸氢铵会分解,温度升高促进亚铁离子的水解;
(5)空气中煅烧碳酸亚铁,是碳酸亚铁和氧气反应生成氧化铁和二氧化碳,原子守恒配平写出;
解答:解:(1)硫铁矿烧渣主要成分为Fe2O3、FeO、SiO2等,酸浸后铁的氧化物和酸反应溶解,二氧化硅不与酸反应,氧化铁溶解后生成铁离子,氧化亚铁溶解后生成亚铁离子,故答案为:Fe2+、Fe3+;
(2)由步骤Ⅱ加入过量铁粉滤液中阳离子为亚铁离子,步骤Ⅲ加入试剂调节溶液pH至5-6.5,试剂不能氧化亚铁离子,强碱性溶液会沉淀亚铁离子,
A.稀硝酸具有氢氧化性能氧化亚铁离子,故A不符合;
B.氨水是弱碱,可以调节溶液PH,故B符合;
C.氢氧化钠溶液 是强碱溶液,加入会沉淀亚铁离子,故C不符合;
D.高锰酸钾溶液具有氢氧化性,能氧化亚铁离子,故D不符合;
故选B;
(3)由浓度商和溶度积常数比较分析判断,Q<Ksp沉淀溶解,Q>Ksp沉淀溶解,Q=Ksp沉淀溶解达到平衡,溶液中c(Fe2+)?c2(OH-)=1.0×10-5×(1×10-6)2=1.0×10-17<Ksp[Fe(OH)2],故无Fe(OH)2沉淀生成,
故答案为:否;溶液中c(Fe2+)?c2(OH-)=1.0×10-5×(1×10-6)2=1.0×10-17<Ksp[Fe(OH)2],故无Fe(OH)2沉淀生成;
(4)步骤Ⅳ的反应温度一般需控制在35℃以下,温度过高碳酸氢铵会分解,温度升高促进亚铁离子的水解,故答案为:防止NH4HCO3分解,减少Fe2+的水解;
(5)空气中煅烧碳酸亚铁,是碳酸亚铁和氧气反应生成氧化铁和二氧化碳,由原子守恒配平后反应的化学方程式为4FeCO3+O2
2Fe2O3+4CO2,
故答案为:4FeCO3+O2
2Fe2O3+4CO2.
(2)由步骤Ⅱ加入过量铁粉滤液中阳离子为亚铁离子,步骤Ⅲ加入试剂调节溶液pH至5-6.5,试剂不能氧化亚铁离子,强碱性溶液会沉淀亚铁离子,
A.稀硝酸具有氢氧化性能氧化亚铁离子,故A不符合;
B.氨水是弱碱,可以调节溶液PH,故B符合;
C.氢氧化钠溶液 是强碱溶液,加入会沉淀亚铁离子,故C不符合;
D.高锰酸钾溶液具有氢氧化性,能氧化亚铁离子,故D不符合;
故选B;
(3)由浓度商和溶度积常数比较分析判断,Q<Ksp沉淀溶解,Q>Ksp沉淀溶解,Q=Ksp沉淀溶解达到平衡,溶液中c(Fe2+)?c2(OH-)=1.0×10-5×(1×10-6)2=1.0×10-17<Ksp[Fe(OH)2],故无Fe(OH)2沉淀生成,
故答案为:否;溶液中c(Fe2+)?c2(OH-)=1.0×10-5×(1×10-6)2=1.0×10-17<Ksp[Fe(OH)2],故无Fe(OH)2沉淀生成;
(4)步骤Ⅳ的反应温度一般需控制在35℃以下,温度过高碳酸氢铵会分解,温度升高促进亚铁离子的水解,故答案为:防止NH4HCO3分解,减少Fe2+的水解;
(5)空气中煅烧碳酸亚铁,是碳酸亚铁和氧气反应生成氧化铁和二氧化碳,由原子守恒配平后反应的化学方程式为4FeCO3+O2
| ||
故答案为:4FeCO3+O2
| ||
点评:本题考查了铁及其化合物性质的分析应用,主要是流程分析理解和反应过程的判断,题目难度中等.

练习册系列答案
相关题目
工业上利用硫铁矿烧渣(主要成分为Fe2O3、FeO、SiO2等)为原料制备高档颜料铁红(Fe2O3 ),具体生产流程如下: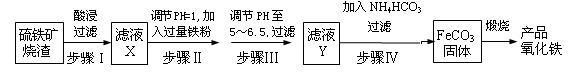
试回答下列问题:
(1)滤液X中含有的金属阳离子是 (填离子符号)。
(2)步骤Ⅲ中可选用 试剂调节溶液的pH(填字母)。
| A.稀硝酸 | B.氨水 | C.氢氧化钠溶液 | D.高锰酸钾溶液 |
(4)步骤Ⅳ的反应温度一般需控制在35℃以下,其目的是 。
(5)在空气中煅烧FeCO3生成产品氧化铁的化学方程式为 。




