题目内容
25℃时,向浓度均为0.1mol.L-1的Fe(NO3)3和Al(NO3)3混合溶液中,逐滴加入NaOH溶液,表示生成Al(OH)3的物质的量与加入的NaOH溶液的体积的关系如下图所示(已知当离子浓度小于1×10-5mol.L-1时为沉淀完全)。则下列说法与判断合理的是
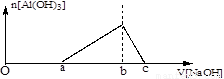
A.25℃时,Fe(OH)3的溶解度大于Al(OH)3的溶解度
B.25℃时,Fe(OH)3的溶度积大于Al(OH)3的溶度积
C.当生成的Al(OH)3恰好完全溶解时,溶液中的溶质只有NaAlO2
D.图中2a=b=6(c-b)
【答案】
D
【解析】
试题分析:A、25℃时,Fe(OH)3的溶解度小于Al(OH)3的溶解度,错误;B、25℃时,Fe(OH)3的溶度积小于Al(OH)3的溶度积,错误;C、溶质还有硝酸钠,错误;D、正确。
考点:难溶物的溶解平衡知识。

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
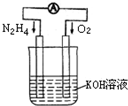 运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义.
运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义. 运用化学反应原理研究以下问题:
运用化学反应原理研究以下问题: 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡
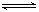 H++A-,其电离常数表达式 Ka= c(H+)·c (A-)/ c (HA)(各浓度为平衡时浓度)。该常数与浓度、压强无关,只是温度的函数。25℃,醋酸的Ka=1.76×10-5
H++A-,其电离常数表达式 Ka= c(H+)·c (A-)/ c (HA)(各浓度为平衡时浓度)。该常数与浓度、压强无关,只是温度的函数。25℃,醋酸的Ka=1.76×10-5
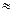 ,列式并说明得出该常数的理由 。
,列式并说明得出该常数的理由 。
