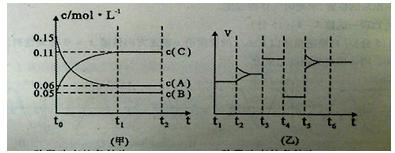
题目内容
已知:25°C时,Ksp〔Mg(OH)2〕=5.61×10-12,Ksp〔MgF2〕=7.42×10-11。下列说法正确的是
| A.25°C时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大 |
| B.25°C时,在Mg(OH)2的悬浊液加入少量的NH4Cl固体,c(Mg2+)增大 |
| C.25°C时,Mg(OH)2固体在20mL0.01 mol·L-1氨水中的Ksp比在20mL0.01mol·L-1NH4Cl溶液中的Ksp小 |
| D.25°C时,在Mg(OH)2的悬浊液中加入NaF溶液后,Mg(OH)2不可能转化为MgF2 |
B
A错,Mg(OH)2与MgF2均属于AB2型,由于Ksp〔Mg(OH)2〕<Ksp〔MgF2〕,所以25°C时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)小;B正确,加入NH4Cl固体后,溶液中NH4+能与溶液中的OH—结合成弱电解质NH3·H2O,促使Mg(OH)2的溶解度增大,溶液中的c(Mg2+)增大;C错,Ksp只受温度影响与其他因素无关;D错,25°C时,在Mg(OH)2的悬浊液中加入NaF溶液后,只要溶液中的F—浓度足够大,Mg(OH)2可能转化为MgF2

练习册系列答案
相关题目
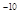 、5.0×10
、5.0×10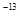 、8.3×10
、8.3×10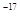 。下列有关说法错误的是 ( )
。下列有关说法错误的是 ( ) Ca2++2OH-
Ca2++2OH-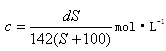


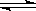 Ag+ + Cl-,现将足量的氯化银分别放入下列选项的溶液中,充分搅拌后,相同温度下,银离子浓度最小的是( )
Ag+ + Cl-,现将足量的氯化银分别放入下列选项的溶液中,充分搅拌后,相同温度下,银离子浓度最小的是( )
 应:Br2 +2Fe2+=2 Br -+2Fe3+,向10 mL0 .1mol/L的Fe Br2溶液中通入0 .003mol Cl2,该反应的离子方程式为
应:Br2 +2Fe2+=2 Br -+2Fe3+,向10 mL0 .1mol/L的Fe Br2溶液中通入0 .003mol Cl2,该反应的离子方程式为  现纳米级的Cu2O可作为太阳光分解水的催化剂。
现纳米级的Cu2O可作为太阳光分解水的催化剂。 ,在2L密闭容器中加入纳米级的Cu2O并通入0 .1mol水蒸气,发生反应:
,在2L密闭容器中加入纳米级的Cu2O并通入0 .1mol水蒸气,发生反应: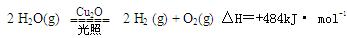 2 H2O(g)
2 H2O(g)