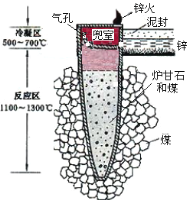
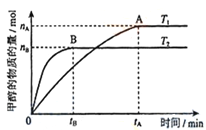
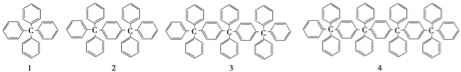
��Ŀ����
����Ŀ���й���ͼװ�õ������У���ȷ������ ��
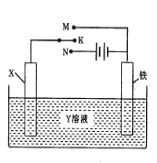
A����XΪп����YΪNaCl��Һ������K����M�����ɼ������ĸ�ʴ�����ַ�����Ϊ��ӵ�Դ������������
B����XΪ̼����YΪ����NaOH��Һ������K����N���������¶Ȳ��䣬����Һ��pH���ֲ���
C����XΪ������YΪ��������Һ������K����N�����������������ӣ���Һ��������Ũ�Ƚ���С
D����XΪͭ����YΪ����ͭ��Һ������K����M����ͭ�����������ӣ���ʱ���·�еĵ��������缫�ƶ�[��
���𰸡�B
��������
���������A������M������װ��Ϊԭ���װ�ã���Ϊп�������ã�п�������������������������ĸ�ʴ�����ַ����������������������������ʴ���B������N�������ɵ���װ�ã����NaOH��Һʵ���ϵ��ʱ��2H2O![]() 2H2����O2������ҺΪ������Һ�����������������������䣬pH���䣬����ȷ��C�����ɵ��أ�XΪ���������ݵ��ԭ����������ӦʽAg��e��=Ag����������Ag����e��=Ag�������������ӣ���Һ������Ũ�Ȳ��䣬�ʴ���D������ԭ��أ�����ͭ���ã�����������ͭ��������������ӦʽΪ��Fe��2e��=Fe2����������ӦʽΪCu2����2e��=Cu��ͭ���������ӣ����Ӵ��������·����ͭ�����ʴ���
2H2����O2������ҺΪ������Һ�����������������������䣬pH���䣬����ȷ��C�����ɵ��أ�XΪ���������ݵ��ԭ����������ӦʽAg��e��=Ag����������Ag����e��=Ag�������������ӣ���Һ������Ũ�Ȳ��䣬�ʴ���D������ԭ��أ�����ͭ���ã�����������ͭ��������������ӦʽΪ��Fe��2e��=Fe2����������ӦʽΪCu2����2e��=Cu��ͭ���������ӣ����Ӵ��������·����ͭ�����ʴ���

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�