题目内容
NH3和Cl2共aL,混合后在一定条件下充分反应,气体体积变为bL,问有多少升的NH3被氧化?已知2NH3+3Cl2=N2+6HCl。
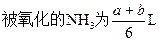
NH3和Cl2混合可发生反应:2NH3+3Cl2=N2+6HCl①,当NH3过量时又可与生成的HCl发生反应:NH3+HCl=NH4Cl②,同时可发生反应:8NH3+3Cl2=N2+6NH4Cl③,第①个反应是氧化还原反应,第②个反应是非氧化还原反应,第③个反应是第①②两个反应的加合。因此在计算前必须判断反应物是适量还是过量,判断的方法可用体积法。
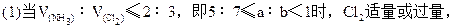
NH3全部被氧化,根据:
2NH3+3Cl2=N2+6HCl 气体体积增大
2 (1+6)-(2+3)=2
b-a b-a
可知被氧化的NH3为(b-a)L。
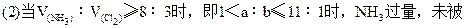
氧化的NH3能与生成的全部HCl反应生成NH4Cl,根据
8NH3+3Cl2=N2+6NH4Cl 气体体积减小
被氧化2 (8+3)-1=10

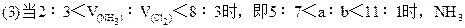
分过量,未被氧化的NH3与生成的部分HCl反应生成NH4Cl。
设被氧化的NH3为x,未被氧化的NH3为y。因为:
2NH3+3Cl2=N2+6HCl NH3+HCl=NH4Cl
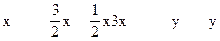
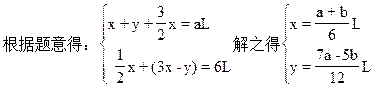
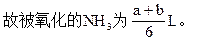
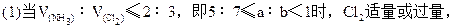
NH3全部被氧化,根据:
2NH3+3Cl2=N2+6HCl 气体体积增大
2 (1+6)-(2+3)=2
b-a b-a
可知被氧化的NH3为(b-a)L。
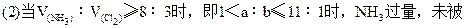
氧化的NH3能与生成的全部HCl反应生成NH4Cl,根据
8NH3+3Cl2=N2+6NH4Cl 气体体积减小
被氧化2 (8+3)-1=10

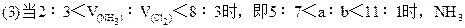
分过量,未被氧化的NH3与生成的部分HCl反应生成NH4Cl。
设被氧化的NH3为x,未被氧化的NH3为y。因为:
2NH3+3Cl2=N2+6HCl NH3+HCl=NH4Cl
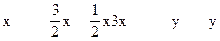
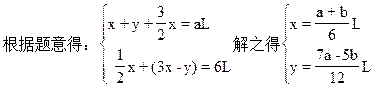
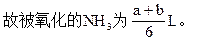

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
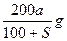
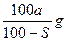
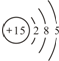 (核内15个中子)
(核内15个中子)