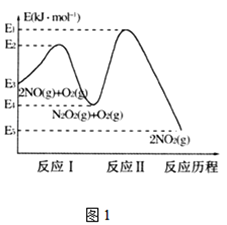
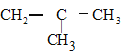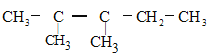题目内容
【题目】质谱图显示,某化合物的相对分子质量为74;燃烧实验发现,该化合物分子内碳、氢原子个数之比为2∶5;核磁共振氢谱显示,该化合物分子中只有两种类型的氢原子。下列关于该化合物的叙述不正确的是( )
A.该化合物可能为![]() 甲基
甲基![]() 丙醇B.该化合物为
丙醇B.该化合物为![]() 丁醇的同分异构体
丁醇的同分异构体
C.该化合物可能为乙醚D.该化合物为乙醚的同系物
【答案】D
【解析】
由有机物分子内碳、氢原子个数之比为2∶5可知,有机物的分子式可记做:C2xH5xOy,又因为相对分子质量为74,所以有机物的分子式只能为C4H10O,且核磁共振氢谱的信息反映有机物中只能含有两种等效氢。
A.2-甲基-2-丙醇的分子式为C4H10O,符合要求;结构为 ,等效氢有两种,符合要求,A项正确;
,等效氢有两种,符合要求,A项正确;
B.2-丁醇的分子式为C4H10O,分子式相同,是同分异构体的关系,B项正确;
C.乙醚分子式C4H10O,符合要求;结构为![]() ,含有两种等效氢原子,符合要求,C项正确;
,含有两种等效氢原子,符合要求,C项正确;
D.乙醚与其互为同分异构体, D项错误;
答案选D。

 应用题作业本系列答案
应用题作业本系列答案【题目】辉铜矿(主要成分Cu2S)作为铜矿中铜含量最高的矿物之一,可用来提炼铜和制备含铜化合物。
Ⅰ.湿法炼铜用Fe2(SO4)3溶液作为浸取剂提取Cu2+:
(1)反应过程中有黄色固体生成,写出反应的离子方程式______________________。
(2)控制温度为85℃、浸取剂的pH = 1,取相同质量的辉铜矿粉末分别进行如下实验:
实验 | 试剂及操作 | 3小时后Cu2+浸出率(%) |
一 | 加入10mL 0.25mol·L-1Fe2(SO4)3溶液和5 mL水 | 81.90 |
二 | 加入10 mL0.25mol·L-1Fe2(SO4)3溶液和5mL 0.1mol·L-1H2O2 | 92.50 |
回答:H2O2使Cu2+浸出率提高的原因可能是__________。
(3)实验二在85℃后,随温度升高,测得3小时后Cu2+浸出率随温度变化的曲线如图。Cu2+浸出率下降的原因_________________。

(4)上述湿法炼铜在将铜浸出的同时,也会将铁杂质带进溶液,向浸出液中通入过量的O2并加入适量的CuO,有利于铁杂质的除去,用离子方程式表示O2的作用_________。解释加入CuO的原因是_____。
Ⅱ.某课题组利用碳氨液((NH4)2CO3、NH3·H2O)从辉铜矿中直接浸取铜。

其反应机理如下:
①Cu2S(s)2Cu+(aq) +S2-(aq) (快反应)
②4Cu++O2+2H2O4Cu2++4OH- (慢反应)
③Cu2++4NH3·H2OCu(NH3)42++4H2O(快反应)
(5)提高铜的浸出率的关键因素是 ________。
(6)在浸出装置中再加入适量的(NH4)2S2O8,铜的浸出率有明显升高,结合平衡移动原理说明可能的原因是__________。