题目内容
铝粉和氧化铁粉末的混合物制成的铝热剂可用于焊接钢轨.现取不同质量的该铝热剂分别和100mL同浓度的NaOH溶液反应,所取铝热剂的质量与产生气体的体积关系如下表(气体体积均在标准状况下测定).
| ① | ② | ③ | |
| 铝热剂质量/g | 7.5 | 18.0 | 20.0 |
| 气体体积/L | 3.36 | 6.72 | 6.72 |
(2)该铝热剂中加入NaOH溶液时发生反应的化学方程式为______
(3)求NaOH溶液的物质的量浓度:
(4)求该铝热剂中铝的质量分数.
解:(1)铝热剂的主要成分为铝和氧化铁,在高温条件下发生置换反应生成铁和氧化铝,
反应的化学方程式为2Al+Fe2O3 2Fe+Al2O3,故答案为:2Al+Fe2O3
2Fe+Al2O3,故答案为:2Al+Fe2O3 2Fe+Al2O3;
2Fe+Al2O3;
(2)铝与NaOH溶液反应生成偏铝酸钠和氢气,反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(3)生成氢气6.72L时,气体的体积不再变化,说明NaOH完全反应,根据方程式计算.
n(H2)= =0.3mol,
=0.3mol,
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2mol 2mol 3mol
n(NaOH) 0.3mol
n(NaOH)=0.2mol,
c(NaOH)=2mol/L,
答:NaOH溶液的物质的量浓度为2mol/L.
(4)加入铝热剂7.5g时,固体完全反应,此时
n(H2)=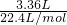 =0.15mol,
=0.15mol,
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2mol 3mol
n(Al) 0.15mol
n(Al)=0.1mol,m(Al)=0.1mol×27g/mol=2.7g
Al%= =36%.
=36%.
答:该铝热剂中铝的质量分数为36%.
分析:(1)铝热剂的主要成分为铝和氧化铁,在高温条件下发生置换反应生成铁和氧化铝;
(2)铝与NaOH溶液反应生成偏铝酸钠和氢气;
(3)根据反应的方程式计算反应中消耗NaOH的物质的量,进而计算物质的量浓度;
(4)根据方程式计算混合物中铝的质量,进而计算质量分数.
点评:本题考查混合物的计算,题目难度中等,注意分析表中数据,判断物质反应的程度.
反应的化学方程式为2Al+Fe2O3
 2Fe+Al2O3,故答案为:2Al+Fe2O3
2Fe+Al2O3,故答案为:2Al+Fe2O3 2Fe+Al2O3;
2Fe+Al2O3;(2)铝与NaOH溶液反应生成偏铝酸钠和氢气,反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(3)生成氢气6.72L时,气体的体积不再变化,说明NaOH完全反应,根据方程式计算.
n(H2)=
 =0.3mol,
=0.3mol,2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2mol 2mol 3mol
n(NaOH) 0.3mol
n(NaOH)=0.2mol,
c(NaOH)=2mol/L,
答:NaOH溶液的物质的量浓度为2mol/L.
(4)加入铝热剂7.5g时,固体完全反应,此时
n(H2)=
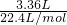 =0.15mol,
=0.15mol,2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2mol 3mol
n(Al) 0.15mol
n(Al)=0.1mol,m(Al)=0.1mol×27g/mol=2.7g
Al%=
 =36%.
=36%.答:该铝热剂中铝的质量分数为36%.
分析:(1)铝热剂的主要成分为铝和氧化铁,在高温条件下发生置换反应生成铁和氧化铝;
(2)铝与NaOH溶液反应生成偏铝酸钠和氢气;
(3)根据反应的方程式计算反应中消耗NaOH的物质的量,进而计算物质的量浓度;
(4)根据方程式计算混合物中铝的质量,进而计算质量分数.
点评:本题考查混合物的计算,题目难度中等,注意分析表中数据,判断物质反应的程度.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
(1)下列有关实验的说法、操作或结论不正确的是 (填序号)
| A.制备Fe(OH)3胶体时,应往沸水中滴加饱和FeCl3溶液,并继续加热到溶液呈红褐色为止。 |
| B.测定中和热实验中,每次实验均应测量三个温度,即盐酸起始温度,NaOH溶液的起始温度和反应后溶液的最高温度。 |
| C.在一定物质的量溶液配制的过程中,没有洗涤烧杯和玻璃棒、定容时加水超过了刻度线、容量瓶没有干燥均会使所配溶液浓度偏低。 |
| D.往FeCl3溶液中滴入KI—淀粉溶液,溶液变蓝色。 |
F.验证AgNO3溶液中是否混有Al(NO3)3,可加入过量氨水,如有白色沉淀,则混有Al(NO3)3
G.稀释浓硫酸时,要将水沿容器壁缓慢注入浓硫酸中,并用玻璃棒不断搅拌。
(2)实验室配制500ml 0.1mol/L的Na2CO3溶液,需用托盘天平称取碳酸钠粉末 g。
配制时应选用的仪器有,托盘天平、药匙、烧杯、量筒、 。