题目内容
【题目】某学习小组对浓硫酸与金属锌的反应进行探究。首先按图组装好实验装置,然后取20mL18.5mo/L的浓硫酸与一定量Zn反应,微热试管A,实验过程中先观察到C、D中均有气泡产生,D中开始出现浑浊,后浑独消失,随后气泡量逐渐减少,品红溶液褪色,反应较长时间后,C、D中的气泡量又会明显增加。试回答:
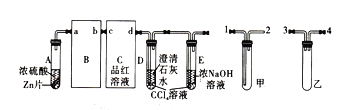
(1)从甲、乙中选择合适的装置填入B、C中,并进行正确连接,a接_____、______接b,c接_____、______接d。
(2)A中产生能使品红溶液褪色的气体的化学方程式为__________________;D、E试管中CCl4溶液的作用是__________。
(3)D中浑浊消失的离子方程式为___________________。
(4)如果锌完全溶解,共生成气体5.6L(标准状况),将反应后的溶液稀释到100mL,测得溶液中H+浓度为0.4mo/L,则反应共消耗锌____g,生成气体的成分及体积之比为_______。
(5)将上述实验中产生的SO2通入酸性高锰酸钾溶液中,高锰酸钾溶液褪色,体现了SO2的___(填“氧化性”“还原性”或“漂白性”),请写出反应的离子方程式____________________。
【答案】 3(或4) 4(或3) 1 2 Zn+2H2SO4(浓)=ZnSO4+SO2 ↑ +2H2O 防止倒吸 SO2+H2O+CaSO3=Ca2++![]() 16.25 V(SO2)∶V (H2)= 2∶3 还原性 5SO2+
16.25 V(SO2)∶V (H2)= 2∶3 还原性 5SO2+![]() +2H2O=
+2H2O=![]() +2Mn2++4H+
+2Mn2++4H+
【解析】试题分析:取20mL18.5mo/L的浓硫酸与一定量Zn反应,微热试管A,实验过程中先观察到C、D中均有气泡产生, D中开始出现浑浊,后浑独消失,随后气泡量逐渐减少,品红溶液褪色,反应较长时间后,C、D中的气泡量又会明显增加。分析以上实验现象可知,浓硫酸与锌反应先生成二氧化硫气体,当硫酸的浓度降低到一定程度后,可以生成氢气。即反应先后可能发生了两个反应,分别是Zn+2H2SO4=ZnSO4+SO2↑+2H2O、Zn+H2SO4=ZnSO4+H2↑,显然,无论生成的气体是二氧化硫还是氢气,气体的物质的量总是等于消耗锌的物质的量。
(1)分析实验装置可知,B中应选用乙装置,作用是防止倒吸;C中选择甲装置,作用是检验二氧化硫;D也是检验二氧化硫的装置;E是尾气吸收处理装置。几个装置的连接顺序为:a接3(或4)、4(或3)接b,c接1、2接d。
(2)A中产生能使品红溶液褪色的气体的化学方程式为Zn+2H2SO4(浓)=ZnSO4+SO2 ↑ +2H2O;二氧化硫是极性分子,四氯化碳是非极性分子,根据相似相溶原理可知,D、E试管中CCl4溶液的作用是防止倒吸。
(3)D中浑浊消失的离子方程式为SO2+H2O+CaSO3=Ca2++![]() 。
。
(4)20mL18.5mo/L的浓硫酸中含硫酸的物质的量为0.37mol。锌完全溶解,将反应后的溶液稀释到100mL,测得溶液中H+浓度为0.4mo/L,溶液中含有0.04molH+,则反应后剩余硫酸的物质的量为0.02mol、反应中共消耗0.35mol硫酸。共生成标准状况的气体5.6L,气体的物质的量为0.25mol,根据反应方程式可知,共消耗锌0.25mol,0.25mol锌的质量为16.25g。因为生成1mol SO2消耗2mol硫酸,而生成1mol H2只消耗1mol硫酸,所以气体与硫酸的物质的量之差就是生成SO2的物质的量,则n(SO2)=0.35mol-0.25mol=0.1mol,n(H2)=0.25mol-0.1mol=0.15mol,V(SO2)∶V (H2)=0.1mol∶0.15mol= 2∶3。
(5)将上述实验中产生的SO2通入酸性高锰酸钾溶液中,高锰酸钾溶液褪色,体现了SO2的还原性,该反应的离子方程式为5SO2+![]() +2H2O=
+2H2O=![]() +2Mn2++4H+。
+2Mn2++4H+。