题目内容
【题目】工业上用铝土矿(主要成分为Al2O3 , 还有少量Fe2O3、SiO2等杂质)提取氧化铝作冶炼铝的原料,提取的操作过程如图所示: 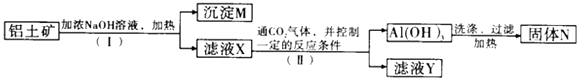
(1)Ⅰ和Ⅱ步骤中分离滤液和沉淀的操作是 .
(2)沉淀M中除含有泥沙外,一定还含有;固体N是 .
(3)滤液X中,含铝元素的溶质的化学式为;它属于(填“酸”“碱”或“盐”)类物质.
(4)实验室里常往AlCl3溶液中加入(填“氨水”或“NaOH溶液”)来制取Al(OH)3 . 发生反应的离子方程式为
(5)向滤液Y中滴加足量盐酸,发生的离子反应方程式为(若没有反应发生,则填“无”)
【答案】
(1)过滤
(2)Fe2O3;Al2O3
(3)NaAlO2;盐
(4)氨水;Al3++3NH3?H2O=Al(OH)3↓+3NH4+
(5)2H++SiO32﹣=H2SiO3↓
【解析】解:Fe2O3和氢氧化钠不反应,而氧化铝、二氧化硅能反应,步骤I利用过滤除去Fe2O3 , 沉淀M为氧化铁等不溶物,溶液X含有偏铝酸钠、硅酸钠,步骤II通入二氧化碳,控制条件使铝离子转化为氢氧化铝沉淀,过滤得氢氧化铝,加热分解氢氧化铝得到氧化铝,滤液Y主要含有硅酸盐.
(1.)I和II步骤分离固体与溶液的方法为过滤;所以答案是:过滤;
(2.)由工艺流程可知,M为Fe2O3 , N为Al2O3;所以答案是:Fe2O3;Al2O3;
(3.)由工艺流程可知,滤液X中,含铝元素的溶质的化学式为:NaAlO2 , 属于盐,所以答案是:NaAlO2;盐;
(4.)氢氧化铝溶于强碱,实验室通常用弱碱氨水与铝盐制备氢氧化铝沉淀,氨水与氯化铝反应生成氢氧化铝与氯化铵,反应方程式为:Al3++3NH3H2O=Al(OH)3↓+3NH4+;所以答案是:氨水; Al3++3NH3H2O=Al(OH)3↓+3NH4+;
(5.)滤液Y主要含有硅酸盐,加入盐酸,生成硅酸沉淀,离子方程式为2H++SiO32﹣=H2SiO3↓,所以答案是:2H++SiO32﹣=H2SiO3↓.

 阅读快车系列答案
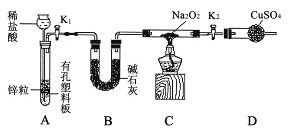
阅读快车系列答案【题目】某强酸性无色溶液中可能含下表离子中的若干种离子。
阳离子 | Mg2+、NH4+、Ba2+、Al3+、Fe2+ |
阴离子 | SiO32-、MnO4-、Cl-、NO3-、SO32- |
实验I :取少量该试液进行如下实验。

实验Ⅱ:为了进一步确定该溶液的组成,取100 mL原溶液,向该溶液中滴加1 mol L-l的 NaOH溶液,产生沉淀的质量与氢氧化钠溶液体积的关系如图所示。

回答下列问题:
(1)不进行实验就可以推断出,上表中的离子一定不存在的有___________种。
(2)通过实验I可以确定该溶液中一定存在的阴离子是_____________。检验气体X的方法是______________________;沉淀Z的化学式为_________________。
(3)写出实验Ⅱ的图象中BC段对应的离子方程式:_____________________________________。
(4) A点对应的固体质量为__________g。
(5)通过上述信息,推算该溶液中阴离子的浓度为______________mol L-l。