题目内容
铝单质既能与盐酸反应产生氢气,又能与氢氧化钠溶液反应产生氢气。试计算:
(1)等质量的铝分别与足量的盐酸和氢氧化钠溶液反应,哪种放出的氢气多:________
(2)取10.5 g表面已氧化了的铝片,投入到100 mL氢氧化钠溶液中,两者恰好完全反应,放出标准状况下的氢气6.72 L,则该氢氧化钠溶液的物质的量浓度为多少?(写出计算过程)
(1)等质量的铝分别与足量的盐酸和氢氧化钠溶液反应,哪种放出的氢气多:________
(2)取10.5 g表面已氧化了的铝片,投入到100 mL氢氧化钠溶液中,两者恰好完全反应,放出标准状况下的氢气6.72 L,则该氢氧化钠溶液的物质的量浓度为多少?(写出计算过程)
(1)一样多 (1分) (2)3 mol·L-1(3分)
(1)铝不论是盐酸反应还是和氢氧化钠反应,铝均是还原剂,化合价都是由0价升高到+3价,即失去3个电子。根据得失电子守恒可知,生成的氢气是一样多。
(2)标准状况下的氢气6.72 L,物质的量是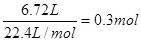 ,则需要消耗铝0.2mol,质量是0.2mol×27g/mol=5.4g。所以原混合物中氧化铝的质量是10.5g-5.4g=5.1g,其物质的量为
,则需要消耗铝0.2mol,质量是0.2mol×27g/mol=5.4g。所以原混合物中氧化铝的质量是10.5g-5.4g=5.1g,其物质的量为 。根据铝原子守恒可知最终溶于中NaAlO2的物质的量是0.2mol+0.05mol×2=0.3mol,所以氢氧化钠溶液的物质的量浓度为
。根据铝原子守恒可知最终溶于中NaAlO2的物质的量是0.2mol+0.05mol×2=0.3mol,所以氢氧化钠溶液的物质的量浓度为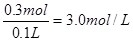
(2)标准状况下的氢气6.72 L,物质的量是
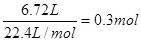 ,则需要消耗铝0.2mol,质量是0.2mol×27g/mol=5.4g。所以原混合物中氧化铝的质量是10.5g-5.4g=5.1g,其物质的量为
,则需要消耗铝0.2mol,质量是0.2mol×27g/mol=5.4g。所以原混合物中氧化铝的质量是10.5g-5.4g=5.1g,其物质的量为 。根据铝原子守恒可知最终溶于中NaAlO2的物质的量是0.2mol+0.05mol×2=0.3mol,所以氢氧化钠溶液的物质的量浓度为
。根据铝原子守恒可知最终溶于中NaAlO2的物质的量是0.2mol+0.05mol×2=0.3mol,所以氢氧化钠溶液的物质的量浓度为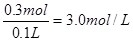

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案
相关题目
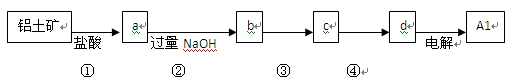
 ,含有杂质
,含有杂质 、
、 、
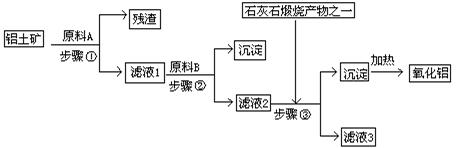
、 。工业上从铝土矿中提取铝可采用如下工艺流程:
。工业上从铝土矿中提取铝可采用如下工艺流程: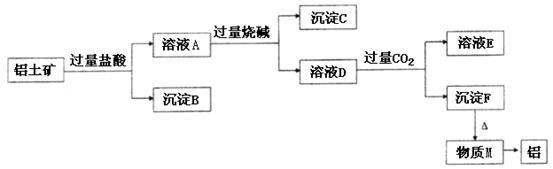
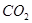 生成沉淀F的离子方程式为________________________。
生成沉淀F的离子方程式为________________________。